
题目列表(包括答案和解析)
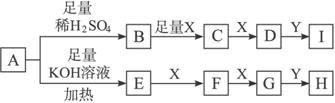
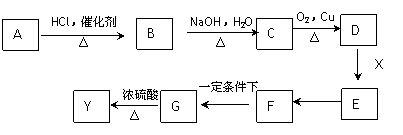
(1)A物质的化学式为____________________。
(2)若Y是__________,则I和H溶液中溶质属于(填“酸”“碱”“盐”或“氧化物”)__________类。
(3)写出发生下列转化的化学方程式:
B→C________________________________________________________________;
E→F_________________________________________________________________。
下图所示装置工作时均与H2有关。
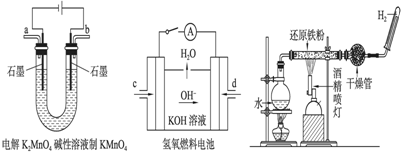
图1 图2 图3
(1) 图1所示装置中阳极的电极反应式为 。
图2所示装置中,通入H2的管口是 (选填字母代号)。
某同学按图3所示装置进行实验,生成固体的主要成分是Fe3O4,其组成也可以表示成FeO·Fe2O3。现提供以下试剂,从中选择合适的药品,证明生成固体中存在+2价铁元素。
试剂:稀盐酸、稀硫酸、稀硝酸、NaOH溶液、KSCN溶液、KMnO4溶液、氯水
选择的药品________
(2)工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g) ![]() CH3OH(g) △H1=-90.8kJ•mol-1
CH3OH(g) △H1=-90.8kJ•mol-1
b.2 CH3OH(g) ![]() CH3OCH3 (g) +H2O(g)△H2=-23.5kJ•mol-1
CH3OCH3 (g) +H2O(g)△H2=-23.5kJ•mol-1
c. CO(g) +H2O(g) ![]() H2(g)+CO2 (g) △H3=-41.3kJ•mol-1
H2(g)+CO2 (g) △H3=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g) ![]() CH3OCH3 (g) + CO2 (g)的
CH3OCH3 (g) + CO2 (g)的![]() 。
。
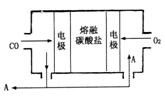 (3)用Na2CO3熔融盐作电解质,CO、O2
(3)用Na2CO3熔融盐作电解质,CO、O2
为原料组成的新型电池的研究取得了重大突破。
该电池示意图如右:
负极电极反应式为________________,
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________。
(4) C1化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式 。
下图中X(C7H6O2)与FeCl3溶液作用显紫色,可用于合成香料Y
E、F、G三种物质分子中含有相同的碳原子数,其中E、F均能与银氨溶液作用。
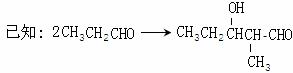
 |
请根据上述信息回答:
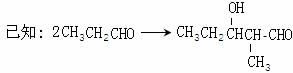
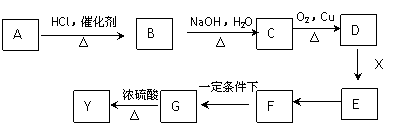
(1)A物质的化学式为_________,D中含氧官能团的名称是__________。
(2)E→F的反应类型为___________,F→G的反应类型为___________。
(3)写出X的能使FeCl3溶液显紫色的同分异构体的结构简式___________、__________。
(4)G在浓硫酸存在的条件下加热反应生成Y的化学方程式为_______________________。
下图中X(C7H6O2)与FeCl3溶液作用显紫色,可用于合成香料Y
E、F、G三种物质分子中含有相同的碳原子数,其中E、F均能与银氨溶液作用。
 |
请根据上述信息回答:
(1)A物质的化学式为_________,D中含氧官能团的名称是__________。
(2)E→F的反应类型为___________,F→G的反应类型为___________。
(3)写出X的能使FeCl3溶液显紫色的同分异构体的结构简式___________、__________。
(4)G在浓硫酸存在的条件下加热反应生成Y的化学方程式为_______________________。
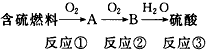
一、选择题(本题包括20小题,1―10题每题2分,11―20题每题3分,共50分。每小题只有一个选项符合题意)
1―5 DCBBA 6―10 CBCCB 11―15 BDCAD 16―20 DAADA
二、(本题包括3小题,共21分)
21.(6分)
(1)KOH(1分)
(2)Ar K+(Ca2+、HS-、S2-、 ) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
(3) (1分)
(1分)
22.(10分)
(1)FeCl2 KSCN(或NH4SCN)溶液(2分)
(2)d(2分)
(3) (2分)
(2分)
(4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+增多从而使红色加深(1分)
(5)假设:加入还原剂将Fe3+还原(1分)
用胶头滴管取少量黄色褪色后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水,如果溶液开始不出现红色,加氯水后出现红色,则说明假设正确,若溶液不变红色,则假设不正确。(2分)(有其他合理假设、答案也可酌情得分)。
23.(5分)
(1) (1分)
(1分)
(2)CH3CHO(1分)
(3)HCOOH(1分)
(4)DE(2分)
三、(本题包括2小题,共15分)
24.(10分)
(1)B、E、F、I(4分,多选、漏选、错选一个扣1分,扣完为止)
(2)D(1分)制氯气的D中进气导管应深入集气瓶底,(1分)逸出的氯气应通入盛有烧碱溶液的烧杯中。(1分)
干燥氨气;(1分)
 (2分)
(2分)
25.(5分)
(1) (1分)
(1分)
(2)甲 现象:气球膨胀
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压使气球胀大。(2分)
乙 现象:烧杯内的水流入锥形瓶中
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压将水压入锥形瓶中。(2分)
四、(本题包括2小题,共14分)
26.(8分)
(1)甲基丙烯或2―甲基丙烯  (2分,各1分)
(2分,各1分)
(2)②取代反应(或水解反应) ④消去反应(2分,各1分)
(3)(2分)

(4) (2分,其他合理写法都给分)
(2分,其他合理写法都给分)
27.(6分)
(1)8.0 mol/L(2分)(注意有效数字)
(2) (或
(或 )(2分)
)(2分)
画图(2分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com