
题目列表(包括答案和解析)
已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |

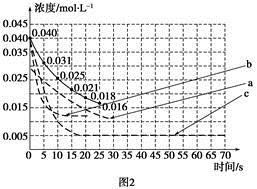
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
 CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |
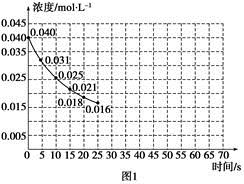
| 实验 编号 | CO2起始 浓度/mol·L-1 | 反应温 度/℃ | 反应压 强/kPa | 是否加入 催化剂 |
| A | 0.030 | 150 | 101 | 否 |
| B | 0.040 | 150 | 101 | 否 |
| C | 0.040 | 250 | 101 | 是 |
(1)已知:① TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
②2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________________。
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
B.CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-676.7 kJ·mol-1
由上述方程式可知,CH3OH的标准燃烧热________(填“大于”“等于”“小于”或“不能确定”)-676.7 kJ·mol-1。已知水的气化热为44 kJ·mol-1,则氢气燃烧的热化学方程式为__________________________。
已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)= ______mol.(L.h)-1。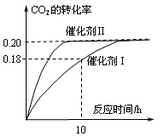
(2)下列叙述正确的是______。(双选)
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数。(写出计箅过程)
(4)将上述平衡体系升温至400°C, 平衡常数:K(4000C) ______ K(3000C) (填<、=或> )。
(5)其它条件不变,若上述反应在催化剂Ⅱ,400°C下达到平衡,请在上图画出CO2转化率随时间变化图。
已知CO2可以生产绿色燃料甲醇。CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g)
ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2)
=" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
(1)使用催化剂I时,反应在10小时内的平均反应速率:V(H2)= ______mol.(L.h)-1。
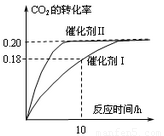
(2)下列叙述正确的是______。(双选)
A.当容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气増大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂II比催化剂I高
D.催化效率:在上述反应条件下,催化剂II比催化剂I高
(3)根椐图中数据,计算此反应在3000C时的平衡常数。(写出计箅过程)
(4)将上述平衡体系升温至400°C, 平衡常数:K(4000C) ______ K(3000C) (填<、=或> )。
(5)其它条件不变,若上述反应在催化剂Ⅱ,400°C下达到平衡,请在上图画出CO2转化率随时间变化图。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com