
题目列表(包括答案和解析)
CuSO4·5H2O![]() CuSO4·3H2O
CuSO4·3H2O![]() CuSO4·H2O
CuSO4·H2O![]() CuSO4
CuSO4
某课外活动小组准备用浓硫酸和铜片为主要原料制取少量胆矾,其主要步骤有:①取少量铜片放在干燥的蒸发皿内,用酒精灯灼烧到其表面变黑为止;②向蒸发皿内加入一定量浓硫酸并加热,反应结束后发现有少量黑色固体及白色固体存在;③将上述冷却后的反应混合物用水稀释得蓝色溶液,白色固体消失,但仍有黑色固体存在;④向稀释后的所得溶液中加入过量碱式碳酸铜[Cu2(OH)2CO3],充分搅拌;⑤过滤,弃去不溶物;⑥将滤液转回洗净的蒸发皿内,用沸水浴缓缓加热蒸发,浓缩至表面有晶膜析出时为止,取下蒸发皿使溶液冷却,析出蓝色晶体。
(1)步骤⑤中要用到的玻璃仪器有_________________________________________________。
(2)步骤④中发生反应的离子方程式是____________________________________________。
(3)简述步骤③的具体操作方法:________________________________________________。
(4)下列叙述错误的是_____________
A.将铜片灼烧,可以减少浓硫酸的消耗量
B.用浓硫酸溶解灼烧后的铜片时,应在通风橱中进行
C.步骤②中得到的黑色固体是CuO
D.步骤②中得到的白色固体是CuSO4
E.步骤⑥中为加快蒸发速度,也可用酒精灯直接给蒸发皿加热
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol/L) | NaOH的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s) ![]() Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA的浓度/(mol/L) | NaOH的浓度/(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s) ![]() Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
Ⅰ、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA的浓度/(mol/L) |
NaOH的浓度/(mol/L) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
请回答:
(1)不考虑其它的实验结果,单从甲组情况分析,若a 7(填“>”、“<”或“=”)则HA为弱酸;
(2)不考虑其它组的实验结果,仅从乙组情况分析,则下列叙述一定错误的是
A.酸溶液的物质的量浓度大于碱溶液
B.酸溶液中H+的浓度大于碱溶液中OH-的浓度
C.酸溶液的物质的量浓度小于碱溶液
D.酸溶液中H+的浓度小于碱溶液中OH-的浓度
E.两种溶液的物质的量浓度相等
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。 若此时10mL0.5mol/LNaA溶液与6mL1mol/L盐酸混合后,溶液中除OH—外的各离子浓度由大到小顺序为 ;
(4)丁组实验所得混合溶液中由水电离出来的c(OH—)= mol/L。
(5)假设HA是一元弱酸,而难溶物CaA2在水中存在溶解平衡:CaA2(s)  Ca2++2A-
Ca2++2A-
△H>0,一定温度下CaA2饱和溶液中Ksp=c(Ca2+)c2(A2-)为一常数。
①温度升高时,Ksp (填“增大”、“减小”或“不变”)。
②测得25℃时,CaA2的Ksp为4.0×10-11,常温下将10g CaA2固体投入100mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1mol/L,则溶液中c(A2-)= 。
Ⅱ、平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。


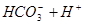









请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
(1)将少量的氯气通入到过量的碳酸钠溶液中___ _____________;
(2)氯气和碳酸钠按照1︰1的物质的量之比恰好反应_______________________________;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com