
题目列表(包括答案和解析)
(16分).某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
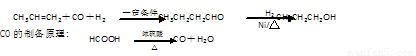
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸,2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: ▲ 、 ▲ ;

(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 ▲ 、 ▲ ;c和d中承装的试剂分别是 ▲ , ▲ ;若用以上装置制备H2,气体发生装置中必需的玻璃仪器e、f名称是 ▲ 、 ▲ ;在虚线框内画出收集H2干燥的装置图 ▲ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 ▲ 。(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3 (饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:

试剂1为 ▲ ;操作1为 ▲ ;操作2为 ▲ ;操作3为 ▲ 。
(16分).某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: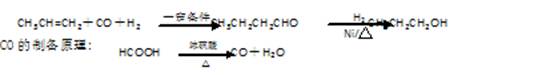
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸,2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: 、 ;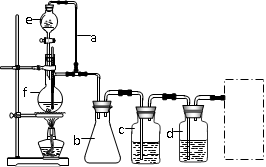
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 、 ;c和d中盛装的试剂分别是 , ;若用以上装置制备H2,气体发生装置中必需的玻璃仪器e、f名称是 、 ;在虚线框内画出收集干燥H2的装置图 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 。(填序号)
①饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3 (饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
试剂1为 ;操作1为 ;操作2为 ;操作3为 。
(16分).某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸,2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式: ▲ 、 ▲ ;
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是 ▲ 、 ▲ ;c和d中承装的试剂分别是 ▲ , ▲ ;若用以上装置制备H2,气体发生装置中必需的玻璃仪器e、f名称是 ▲ 、 ▲ ;在虚线框内画出收集H2干燥的装置图 ▲ 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 ▲ 。(填序号)
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3 (饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
试剂1为 ▲ ;操作1为 ▲ ;操作2为 ▲ ;操作3为 ▲ 。
某化学研究性学习小组讨论Fe3+和SO32—之间发生怎样的反应,提出了两种可能:
一是发生氧化还原反应:2Fe3++SO32—+H2O=2Fe2++SO42—+2H+;
二是发生双水解反应:2Fe3++3SO32—+6H2O=2Fe(OH)3(胶体)+3H2SO3。
为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
【实验Ⅰ】学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是 。
【实验Ⅱ】取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色“液体”是 ;向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是. ;
将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,另一份加入BaCl2稀溶液,有少量白色沉淀生成。产生血红色现象的离子方程式是 。
【实验Ⅲ】换用稀释的FeCl3和Na2SO3溶液重复实验,Ⅱ、Ⅲ产生的现象完全相同。由上述实验得出的结论是 ;
若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是. 。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
① ;
② 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com