
题目列表(包括答案和解析)
氢元素与其它元素形成的二元化合物称为氢化物,下面关于氢化物的叙述正确的是( )
A.一个D2O分子所含的中子数为8 B.NH3的结构式为![]()
C.HCl的电子式为![]() D.热稳定性:H2S > HF
D.热稳定性:H2S > HF
元素A、B、C都是短周期元素,它们的原子序数A<B<C.A元素原子的最外层电子数为次外层电子数的二倍;B元素的原子的次外层电子数是最外层电子数的二倍.B与C可形成共价化合物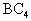 .试回答:
.试回答:
(1)三种元素符号A________,B________,C________.
(2)气态氢化物化学式依次为________,________,________,其中最不稳定的是________,它在空气中燃烧的化学方程式为________.
(3)它们的高价氧化物的水化物中酸性最强的是________,最弱的是________.
(4)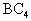 的化学式________,电子式________.
的化学式________,电子式________.
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | x |
| Y3+ | 6.0 | 8.2 |
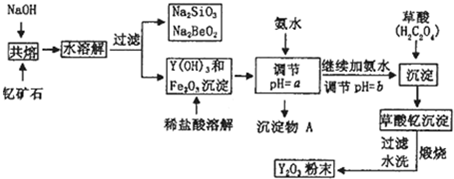
(10分)稀土元素是周期表中IIIB族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
|
| 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2FeBe2Si2O10)的组成用氧化物的形式可表示为 ▲ 。
(2)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、 ▲ (填字母)两种试剂,再通过必要的操作即可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: ▲ 。
(3)为使Fe3+沉淀完全,须用氨水调节pH = a,则a应控制在 ▲ 的范围内;检验Fe3+是否沉淀完全的操作方法是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com