
题目列表(包括答案和解析)
下列各项中的两个量,其比值一定为1:2的是
A. 固体Na2O2中阴离子与阳离子的个数
B. 相同温度下0.l mol /L的CH3COOH与 0.2mol /L的CH3COOH溶液中的c(H+)
C. 液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛溶液的体积
D. 在反应2H2S + SO2= 3S ↓ + 2H2O中氧化产物与还原产物的质量
(10分)![]() 同学们为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K或308K。
同学们为了探究镁条与盐酸、醋酸反应时浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K或308K。
(1)该实验缺少的仪器是 。
(2)酸液都取足量、相同体积,请你帮助完成以下面实验设计表:
实验
| 温度(K) | 盐酸浓度
| 醋酸浓度(mol?L-1) | 实验目的 |
① | 298 | 0.20 |
| a.实验①和②是探究 对镁与盐酸反应速率的影响;
|
② | 308 | 0.20 |
| |
③ | 298 | 0.40 |
| |
④ |
| 0.20 |
|
(3)预测:相同温度、相同浓度时,刚开始时两者产气的速率盐酸 醋酸(“填:=、>、<”),镁条最先消失的是 ;如果镁条足量时,选pH相同、等体积的盐酸和醋酸,产气最多的是 。
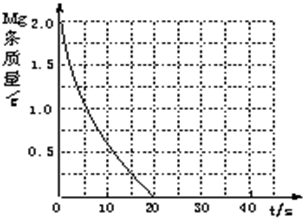
(4)若(2)中实验①镁条消失的时间是20s,则镁条剩余质量与时间关系图如右图。假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的镁条质量与时间关系曲线。
(08山东临沂质检)下列各项中的两个量,其比值一定为1:2的是()
A. 固体Na2O2中阴离子与阳离子的个数
B. 相同温度下0.l mol /L的CH3COOH与 0.2mol /L的CH3COOH溶液中的c(H+)
C. 液面在“0”刻度时,25mL碱式滴定管和50mL碱式滴定管所盛溶液的体积
D. 在反应2H2S + SO2= 3S ↓ + 2H2O中氧化产物与还原产物的质量
| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | a.实验①和②是探究 不同温度 不同温度 对镁与盐酸反应速率的影响;b.实验①和③是探究 不同浓度 不同浓度 对镁与盐酸反应速率的影响;c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. | |
| ② | 308 | 0.20 | ||
| ③ | 298 | 0.40 | ||
| ④ | 298 298 |
0.20 0.20 |
| 1 |
| 2 |
1-5 BCBDC 6-10 CABDB 11-15 ABBBB 16-20 DDCAB
21.(12分)(1)66.7%(2分), 46.7%(2分),
6 (NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2(2分)
②C3H6N6+3H2O=C3N3(OH)3+3NH3
(2) ①N2H4+H2O NH2NH3+(N2H5+)+OH- (2分)
NH2NH3+(N2H5+)+OH- (2分)
(NH2NH3++ H2O NH3NH32++OH- )
NH3NH32++OH- )
② CO(NH2)2+ NaClO+ 2NaOH = N2H4+NaCl+Na2CO3 +H2O (2分)
22答案(16分)
(1)C、Ca、Br (各2分)
(2)白磷 红磷 (各2分)
(3)PCl3+3H2O=H3PO3+3HCl (2分)
(4)18 8 (各2分)
23(12分)答案. (1)BE
(2)
(3)有 ①C试管的塞子换成双孔塞,另一孔插入一根直导管;②在A、B之间加一个干燥管
(4)浓氨水 生石灰或氢氧化钠 水 黑色氧化铜粉末变红色粉末,试管内壁有水珠
(5)水浴加热烧杯 银氨溶液 M处红棕色粉末变成黑色粉末,烧杯里有银镜产生

|