
题目列表(包括答案和解析)
(共10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:

(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
X、Y、Z、M均为短周期非金属元素,其原子序数按由小到大排列。X可分别与Y、Z、M组成10电子共价化合物。X、Z、M三种元素可形成离子化合物。
(1) 写出元素的名称:X. ,Z. 。
(2) 已知有反应2ZX3+3CuO=Z2+3Cu+3X2O,利用下图所示装置和必要的用品,可以进行制取ZX3并证明ZX3具有还原性的实验。
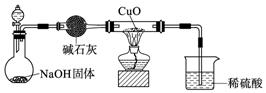
① 分夜漏斗中的溶液可能是 或 (填写名称)。
② 证明ZX3具有还原性的实验现象是 。
③ 上述装置有一不当之处,请在下面方框中画出改进部分的装置图。

(3) 物质的检验和分离,是化学实验的基本操作。
① X与Z元素可共同组成一种常见的阳离子,写出检验该离子的实验操作及现象。
实验操作: ;
现象: 。
② 下列混合物的分离和提纯方法:① 渗析② 蒸馏③ 过滤④ 分液,其中基本原理相近的是下列的 (填序号)。
A. ①和② B. ③和④ C. ①和③ D. ②和④
| ||
| ||
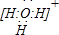
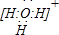




1-5 BCBDC 6-10 CABDB 11-15 ABBBB 16-20 DDCAB
21.(12分)(1)66.7%(2分), 46.7%(2分),
6 (NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2(2分)
②C3H6N6+3H2O=C3N3(OH)3+3NH3
(2) ①N2H4+H2O NH2NH3+(N2H5+)+OH- (2分)
NH2NH3+(N2H5+)+OH- (2分)
(NH2NH3++ H2O NH3NH32++OH- )
NH3NH32++OH- )
② CO(NH2)2+ NaClO+ 2NaOH = N2H4+NaCl+Na2CO3 +H2O (2分)
22答案(16分)
(1)C、Ca、Br (各2分)
(2)白磷 红磷 (各2分)
(3)PCl3+3H2O=H3PO3+3HCl (2分)
(4)18 8 (各2分)
23(12分)答案. (1)BE
(2)
(3)有 ①C试管的塞子换成双孔塞,另一孔插入一根直导管;②在A、B之间加一个干燥管
(4)浓氨水 生石灰或氢氧化钠 水 黑色氧化铜粉末变红色粉末,试管内壁有水珠
(5)水浴加热烧杯 银氨溶液 M处红棕色粉末变成黑色粉末,烧杯里有银镜产生

|