能源是人类生存和发展的重要支柱.研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义.已知下列热化学方程式
①2H
2(g)+O
2(g)=2H
2O(l)△H=-570kJ/mol;
②H
2(g)+
O
2(g)=H
2O(g)△H=-242kJ/mol;
③C(s)+
O
2(g)=CO(g)△H=-110.5kJ/moL;
④C(s)+O
2(g)=CO
2(g)△H=-393.5kJ/moL;
⑤CO
2(g)+2H
2O(g)=2CH
4(g)+2O
2(g)△H=+890kJ/moL
回答下列问题
(1)H
2的燃烧热为
.
(2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然难直接测定,但可通过间接的方法求得.已知C(s)+H
2O(g)=H
2(g)+CO(g)△H=akJ/moL;
则a=
;该反应的熵△S
0(选填“>”、“=”、“<”);已知自由能△G=△H-T△S,当△G<0时可自发进行.则该反应在什么条件下可自发进行
.
(3)事实证明,能设计成原电池的反应通常是放热反应.
①下列化学反应在理论上可以设计成原电池的是
.
A.C(s)+H
2O(g)=CO(g)+H
2(g)△H>0
B.2H
2(g)+O
2(g)=2H
2O(l)△H<0
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H
2O(l)△H<0
②以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为
.
(4)有同学利用CuSO
4溶液,进行以下实验探究.
①图一是根据反应Zn+CuSO
4=Cu+ZnSO
4 设计成的锌铜原电池.
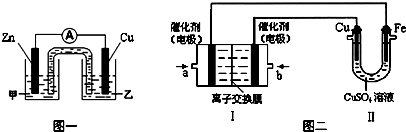
电解质溶液乙是
(填“ZnSO
4”或“CuSO
4”)溶液;Cu极的电极反应式是
.
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是
(填“CH
4”或“O
2”),a处电极上发生的电极反应式是
.

