
题目列表(包括答案和解析)
已知![]() 和
和![]() 两种离子的电子层结构相同,则a等于
两种离子的电子层结构相同,则a等于
A.b+m+n B.b+m-n
C.b-m+n D.b-m-n
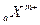 和
和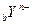 两种离子的电子层结构相同,则a等于
两种离子的电子层结构相同,则a等于| A.b+m+n | B.b+m-n |
| C.b-m+n | D.b-m-n |
已知![]() 和
和![]() 两种离子的电子层结构相同,则a等于( )
两种离子的电子层结构相同,则a等于( )
A.b+m+n B.b+m-n
C.b-m+n D.b-m-n
| 熔点 | 沸点 | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
| 元素 | X | F | |
| 电离能kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com