
题目列表(包括答案和解析)
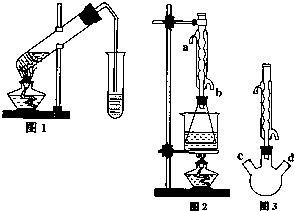 乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸.某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量.
乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸.某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量.| 乙酸乙酯 | 乙醇 | 乙酸 | |
| 沸点 | 77.1℃ | 78.5℃ | 117.9℃ |
乙酸乙酯是重要的工业原料和溶剂.现利用如图装置制取乙酸乙酯的粗产品,再测定乙酸乙酯的含量.

(1)写出反应方程式________(反应)
(2)实验室一般用饱和碳酸钠溶液接收反应的生成物.若不振荡该试管,可看到的现象是________,若振荡该试管,可看到的现象是________,但是有却出现了白色晶体,该晶体是________;
(3)对于制乙酸乙酯的上述装置,为了提高产率,请提出一条改进意见:
________.
(4)为测定乙酸乙酯的含量,进行如下操作:
(Ⅰ)准确称量20.0 g乙酯乙酯粗品于锥形瓶中,用0.50 mol/L NaOH滴定(酚酞做示剂).终点时消耗NaOH溶液的体积为40.0 mL
(Ⅱ)另取20.0 g乙酸乙酸粗产品于250 mL锥形瓶中,加入100 mL的2.1 mol/L NaOH溶液混合增色匀后,装上冷凝管,在水浴上加热回流约1小时,装置如图所示.待冷却后,用0.50 mol/LHC1滴定过量的NaOH.终点时消耗盐酸的体积为20.0 mL.
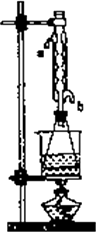
回答:①实验(Ⅰ)中达到滴定终点时的现象是________.
②实验(Ⅱ)中冷水从冷水凝管的________(填a或b)管口通入.
③利用实验(Ⅰ)、(Ⅱ)测量的数据计算粗产物中乙酸乙酯的质量分数为________.
 酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业.乙酸乙酯的实验室和工业制法常用冰醋酸、无水乙醇和浓硫酸混合,在加热条件下反应制得:| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。
乙酸乙酯的实验室和工业制法常采用如下反应:
![]()
请根据要求回答下列问题:
⑴欲提高乙酸的转化率,可采取的措施有: 、 等。
⑵若用上图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:
、 等。
⑶此反应以浓硫酸为催化剂,可能会造成 、 等问题。
⑷目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(/%) | 选择性(/%)* | 反应时间/h | 转化率(/%) | 选择性(/%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120 ℃,4 h B.80 ℃,2 h C.60 ℃,4 h D.40 ℃,3 h
②当反应温度达到120 ℃时,反应选择性降低的原因可能为 。
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。
乙酸乙酯的实验室和工业制法常采用如下反应:
请根据要求回答下列问题:
⑴欲提高乙酸的转化率,可采取的措施有: 、 等。
⑵若用上图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:
、 等。
⑶此反应以浓硫酸为催化剂,可能会造成 、 等问题。
⑷目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 | 同一反应温度 | ||||
| 反应温度/℃ | 转化率(/%) | 选择性(/%)* | 反应时间/h | 转化率(/%) | 选择性(/%)* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
| A.120 ℃,4 h | B.80 ℃,2 h | C.60 ℃,4 h | D.40 ℃,3 h |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com