
题目列表(包括答案和解析)
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程: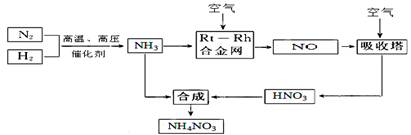
回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)="2.0" × 10-5 mol·L-1)。
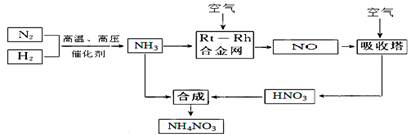
(15分)硝酸铵在现代农业生产和国防中都占有重要地位,下图是云南天然气化工厂合成硝酸铵的简要生产工艺流程:

回答下列问题:
(1)N2的电子式 ,合成氨的反应中,若生成1g氨放出热量a KJ,写出该反应的热化学方程式 。
(2)氨催化氧化的化学方程式是 ,
试从化学反应速率和化学平衡原理分析温度、压强对合成氨反应的影响 。
(3)若输送NH3的管道某处发生泄漏,检测的简单方法 。
(4)农业生产上长期、过量使用化肥硝酸铵,会加重土壤酸化,原因是(用离子方程式回答) 。
(5)25℃时,将x mol NH4NO3溶于一定量水中,向该溶液中滴加y L氨水后溶液呈中性,则滴加氨水过程中水的电离平衡将 (填“正向” “不”或“逆向”)移动,所滴加氨水的物质的量浓度为 (25℃时,Kb(NH3·H2O)=2.0 × 10-5 mol·L-1)。
| ||
| ||
测定银铜合金的成分,将30 g合金溶于80 mL 13.5 mol/L的浓硝酸中,完全溶解后,收集气体6.72 L(换算成标准状况且不考虑N2O4),并测得溶液的PH=0,设溶液体积不变,仍为80 mL,计算(只在答题纸上填结果)
(1)被还原的硝酸物质的量
(2)合金中银的质量分数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com