
题目列表(包括答案和解析)
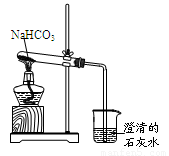
(5分)实验室利用图所示装置进行NaHCO3的受热分解实验。请回答:
(1)加热一段时间后,烧杯中观察到的实验现象是 。
(2)实验结束时的正确操作是 (填序号),否则会引起 。
① 先将导管从液体中移出,再熄灭酒精灯
② 先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是 。
(5分)实验室利用图所示装置进行NaHCO3的受热分解实验。请回答:
(1)加热一段时间后,烧杯中观察到的实验现象是 。
(2)实验结束时的正确操作是 (填序号),否则会引起 。
① 先将导管从液体中移出,再熄灭酒精灯
② 先熄灭酒精灯,再将导管从液体中移出
(3)NaHCO3受热分解的化学方程式是 。
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用右图的装置制备乙酸乙酯.| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol?L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白
作脱氯剂等。实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
(1)用图所示装置制取Na2S2O3,其中NaOH溶液的作用是 。如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有 (填化学式)杂质生成。
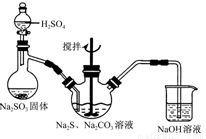
(2)为测定所得保险粉样品中Na2S2O3·5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2=2NaI+Na2S4O6。
①利用KIO3、KI和HCl可配制标准碘溶液。写出配制时所发生反应的离子方程式: 。
②准确称取一定质量的Na2S2O3·5H2O样品于锥形瓶中,加水溶解,并滴加 作指示剂,滴定终点的现象是 。
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O3·5H2O的质量分数会 (填“偏高”、“偏低”或“不变”)。
(3)本实验对Na2S的纯度要求较高,利用图所示的装置可将工业级的Na2S提纯。已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精。提纯步骤依次为:
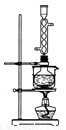
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待烧瓶中固体不再减少时,停止加热,将烧瓶取下;
④趁热过滤;
⑤ ;
⑥将所得固体洗涤、干燥,得到Na2S·9H2O晶体。
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol?L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com