
题目列表(包括答案和解析)





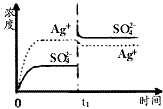
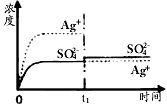
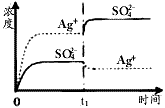
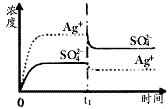
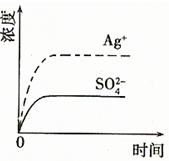
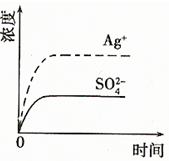 (1)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,请计算可逆反应H2CO3
(1)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1.若忽略水的电离及H2CO3的第二级电离,请计算可逆反应H2CO3 HCO3-+H+的平衡常数K1.(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1.(已知10-5.60=2.5×10-6)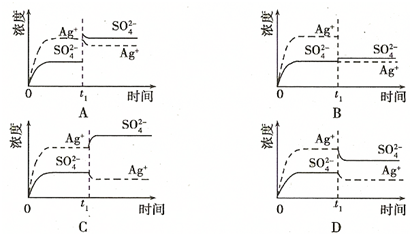

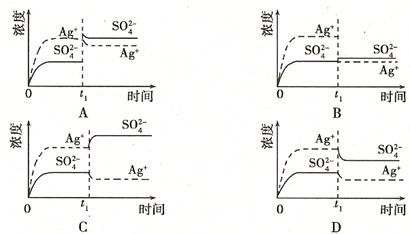
 HCO3-+H+的平衡常数K1.(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1.(已知10-5.60=2.5×10-6)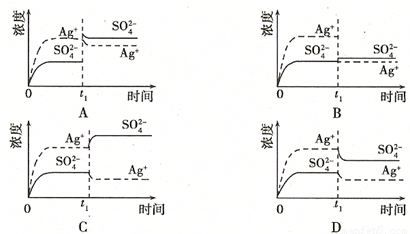
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com