
题目列表(包括答案和解析)
(共8分)
Ⅰ.(2分)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol?L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)。
(2)(6分)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂是 (填化学式)。
Ⅱ.如图所示,若电解5min时铜电极质量增加2.16g,B池的两极都有气体产生。
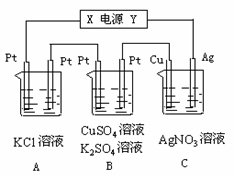 试回答:
试回答:
⑴ 电源电极X名称为____________。
⑵ pH变化:A池________________,
B池________________,
C池________________。
⑶ 写出B池中所发生的电解反应方程式:
_____________________________________________________________________。
| A.高碘酸和碘酸都是强酸 |
| B.高碘酸和碘酸都是弱酸 |
| C.高碘酸是弱酸、碘酸是强酸 |
| D.高碘酸是强酸、碘酸是弱酸 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com