
题目列表(包括答案和解析)
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
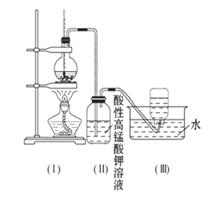
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯: CH3CH2OH CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了。
(1)你认为哪个同学的观点正确? _____ (填“甲”或“乙”),理由是(从下列选项中选)_____
| A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应 |
| B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应 |
| C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物 |
| D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性 |
如图所示,在实验室里,通常利用浓硫酸与乙醇混合加热制乙烯: CH3CH2OH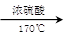 CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
酸性高锰酸钾溶液褪色,甲同学认为能证明乙烯被酸性高锰酸钾溶液氧化了;乙同学认为不能证明乙烯被酸性高锰酸钾溶液氧化了。
(1)你认为哪个同学的观点正确? _____ (填“甲”或“乙”),理由是(从下列选项中选)_____
A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应
B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应
C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物
D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性
(2)丙同学取(Ⅱ)瓶中少量溶液于试管里,加入盐酸和氯化钡溶液,产生白色沉淀,他认为乙烯中一定混有二氧化硫,你认为他的结论是否可靠? _____ (填“可靠”或“不可靠”);理由是_____________________ 。
(3)丁同学想证明乙烯能否与溴发生反应,于是对上述实验进行了改进,改进的方法是:在装置(Ⅰ)和(Ⅱ)之间增加一个装有足量_____的洗气瓶,且将(Ⅱ)瓶中溶液换成_____ 。发生加成反应的化学方程式为
(10分)在实验室里可以用如下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质(固定装置略去)。图中①为制取氯气的装置;②试管中装有15mL30%KOH溶液,并置于热水中,制取氯酸钾;③试管中装有15 mL 8%NaOH溶液,并置于冰水中;④中装有紫色石蕊试液。

(1)③试管中制取次氯酸钠的化学方程式为
(2)实验中可观察到④试管中溶液的颜色发生如下变化,填写表格。
|
实验现象 |
原因 |
|
溶液最初从紫色变为 色 |
氯气与水反应生成的HCl使石蕊试液变红 |
|
随后溶液逐渐变为无色 |
|
|
最后溶液从无色逐渐变为 色 |
|
(3)此实验有一个明显的不足之处,应如何改进?
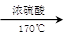 CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
CH2=CH2↑+H2O,加热一段时间后溶液中有黑色现象出现。过一段时间后,经硫酸酸化的高锰酸钾溶液褪色。经分析得知:产生的气体中含有CH2=CH2、SO2、CO2、H2O。
| A.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了氧化反应 |
| B.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,能证明乙烯发生了加成反应 |
| C.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,不能证明通入的气体是纯净物 |
| D.(Ⅱ)瓶中酸性高锰酸钾溶液褪色,只能证明通入的气体一定具有还原性 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com