
题目列表(包括答案和解析)
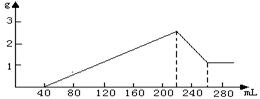 某合金经分析知含有Fe、Al、Si三种单质,为测定合金的组成,某课外小组取一定量的合金与500mL稀H2SO4反应,生成aL标况下的H2,反应溶液经过滤后,向滤液中加适量的硝酸钾恰好使溶液中的Fe2+全部氧化(还原产物只有NO),再向其中加入0.5mol/L的NaOH溶液,所加NaOH溶液体积与产生沉淀的质量变化如图所示。另再取相同质量量的合金,与足量的NaOH反应,也产生aL标况下的H2。
某合金经分析知含有Fe、Al、Si三种单质,为测定合金的组成,某课外小组取一定量的合金与500mL稀H2SO4反应,生成aL标况下的H2,反应溶液经过滤后,向滤液中加适量的硝酸钾恰好使溶液中的Fe2+全部氧化(还原产物只有NO),再向其中加入0.5mol/L的NaOH溶液,所加NaOH溶液体积与产生沉淀的质量变化如图所示。另再取相同质量量的合金,与足量的NaOH反应,也产生aL标况下的H2。
试求:(1)所加硝酸钾的物质的量
(2)合金中各种单质的质量分数
(3)所加稀硫酸的物质的量浓度
向1.00 L0.3mol / L 的NaOH 溶液中缓慢通入0.2molCO2气体,使其完全反应,对反应后的溶液,下列判断正确的是
A.溶质只有Na2CO3 B.c(CO32-)> c(HCO3-)
C.c(OH-)>c(HCO3-) D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)[
下列推断或表述正确的是 ( )
A.分别将体积各为1L的1mol/L NaCI溶液和1mol/L的NaF溶液加水稀释至100L,两溶液离子总数相等
B.将pH =a的醋酸溶液稀释100倍,稀释液pH=b,则b=a+2
C.0.2mol/L的盐酸与0.05mol/L的Ba( OH)2溶液等体积混合,混合液pH =1
D.向1L,0.3mol/L的NaOH溶液缓缓通入CO2气体,至溶液质量增加8.8g,则溶液中:
2c(Na+) 3[c(HCO3-)+c(CO32-)+c(H2CO3)]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com