
题目列表(包括答案和解析)
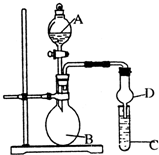 已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:
已知氢氧化铝既能与强酸反应,也能与强碱反应,但不能与弱酸和弱碱反应.某研究小组利用如图所示装置验证氢氧化铝的上述某些性质(试管C中盛有含铝元素的盐溶液),回答下列问题:(6分)某碳酸钠和碳酸氢钠的混合物用酒精灯加热至不再产生气体为止,固体质量减少了0.62 g。剩余固体冷却后与足量的稀盐酸充分反应,产生标准状况下的二氧化碳气体1792 mL。试计算该混合物中碳酸钠和碳酸氢钠的物质的量之比是多少?
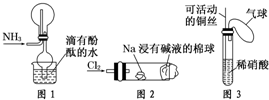 “绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 ①实验室收集氨气采用图所示装置 ②实验室中做氯气与钠的反应实验时采用图所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验 ④实验室中采用图所示装置进行铜与稀硝酸的反应( )
“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 ①实验室收集氨气采用图所示装置 ②实验室中做氯气与钠的反应实验时采用图所示装置 ③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验 ④实验室中采用图所示装置进行铜与稀硝酸的反应( )中学阶级介绍的应用电解法制备的物质主要有三种:一是铝的工业制备、二是氯碱工业、三是金属钠的制备。下列关于这三个工业生产的描述中正确的是
A.电解法制金属钠时,负极反应式:Na+ + e-= Na
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是 H2,NaOH 在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaCl ,在电解时它们的阴极都是 C1一 失电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com