
题目列表(包括答案和解析)
Ⅰ.称取
Ⅱ.将Ⅰ中所得溶液分成两等份,一份加入酚酞溶液呈红色,用浓度为4.0 mol·L-1?的盐酸中和,用去该盐酸12.5 mL。将另一份用稀硝酸酸化,无气体产生,再加入过量的Ba(NO3)2溶液,得白色沉淀,质量为
Ⅲ.将Ⅰ中所得的
(1)定性分析:由上述实验现象(不进行数据的计算)可以确定该粉末中一定不含有的是__________;一定含有的是__________。
(2)定量计算:为了进一步确定该粉末中其他成分是否存在,该同学又对有关数据进行了处理,并最终得出混合物的组成和各成分的物质的量,请写出他的计算过程。
某样品为 、
、 固体混合物.拟将一定质量的样品与稀硫酸反应,用测出生成
固体混合物.拟将一定质量的样品与稀硫酸反应,用测出生成 体积的方法计算出样品中组分的质量分数.为较准确地测出生成的
体积的方法计算出样品中组分的质量分数.为较准确地测出生成的 的体积,在反应结束后加热反应混合液,使溶于溶液的
的体积,在反应结束后加热反应混合液,使溶于溶液的 逸出,待冷却后再测
逸出,待冷却后再测 的体积.(加热时蒸发的水的体积不计)
的体积.(加热时蒸发的水的体积不计)
下面是实验装置,其中B和C可供选择(B、C中所盛的液体为饱和 溶液).
溶液).
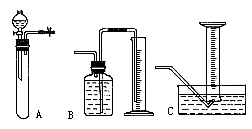
(1)用托盘天平称取样品W g,若所用天平游码的最大刻度为5 g,则与此天平配套的砝码中最小的质量是________(选填编码:A.1 g;B.2 g;C.3 g;D.5 g;E.10 g)
(2)对A进行气密性检查的最简单的方法是________.
(3)已知所用硫酸的浓度为0.5 mol/L,A中试管的规格是20 mm(内径)×200 mm(高度),则在称取样品时,W的值应不大于________ g.测定气体体积所用量筒的规格,合适的是________(A.100 mL;B.200 mL;C.500 mL).
(4)测量 气体的体积时,可选用B、C中的一种与A连接,你将选择(填“B”或“C”),不选另一种的理由是________.
气体的体积时,可选用B、C中的一种与A连接,你将选择(填“B”或“C”),不选另一种的理由是________.
| 2 |
| 3 |
c(N
| ||
| c(OH-) |
(1)若固体恰好完全溶解,消耗硫酸的体积为0.300 L。且所得溶液中无Fe3+,则a=________,混合粉末中铜的质量为________。
(2)若将固体完全溶解于1.00 L上述硫酸中,测得c(Fe3+)=0.100 mol·L-1(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为________g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.300 L,且所得溶液中既有Fe2+,也有Fe2+,则a的取值范围是________________。
(1)若固体恰好完全溶解,消耗硫酸的体积为0.3 L,且所得溶液中无Fe3+,则a=__________,混合粉末中铜的质量为___________。
(2)若将固体完全溶解于1.00 L上述硫酸中,测得c(Fe3+)=0.1 mol·L-1(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为_________g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.3 L,且所得溶液中既有Fe3+,也有Fe2+,则a的取值范围是_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com