
题目列表(包括答案和解析)
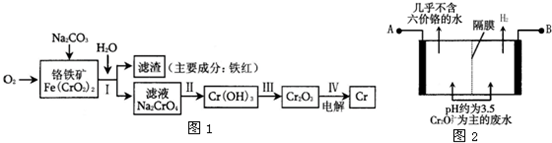
|
已知某不纯的铁粉中含有一种杂质.取 5.6 g该样品与足量稀硫酸充分反应,产生的氢气在标准状况下的体积为2.25 L.则原铁粉中含有的杂质可能是 | |
| [ ] | |
A. |
铝 |
B. |
碳 |
C. |
铜 |
D. |
锌 |
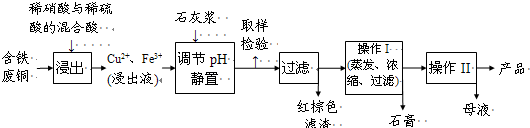
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
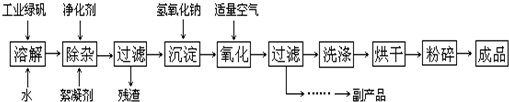
(1)制备氧化铜![]() 工业CuSO4
工业CuSO4![]() CuSO4溶液
CuSO4溶液![]() CuSO4·5H2O→……→CuO
CuSO4·5H2O→……→CuO
①步骤Ⅰ的目的是除不溶性杂质。操作是______________________________。
②步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热:Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是______________________________。
③步骤Ⅲ的目的是得到CuSO4·5H2O晶体,操作是,水浴加热烘干。水浴加热的特点是______________。
(2)①取A、B两支试管,往A中加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是_____________________________。
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器有______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com