
题目列表(包括答案和解析)
某溶液能与Al粉反应放出H2,该溶液中可能大量共存的离子组是
A.NH4+、Ba2+、HCO3-、Cl- B.K+、Al3+、S2-、ClO-
C.Na+、Fe3+、Cl-、SO42- D.H+、Mg2+、SO42-、NO3-
| A.NH4+、Ba2+、HCO3-、Cl- | B.K+、Al3+、S2-、ClO- |
| C.Na+、Fe3+、Cl-、SO42- | D.H+、Mg2+、SO42-、NO3- |
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1mol·Lˉ1 双氧水 | 1 mol·L1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |

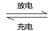 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[探究一] 实验方案:铝镁合金 测定生成气体的体积
测定生成气体的体积
实验装置如下图,问题讨论: 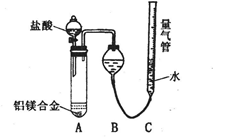
(1)反应完毕,每间隔1分钟读取气体体积,气体体积逐渐减小,直至不变。气体体积减小的原因是
(仪器和实验操作的影响因素除外)。
(2)为使测定结果尽可能精确,实验中应注意的问题除了检查装置的气密性、加入足量盐酸使合金完全溶解和按(1)操作外,请再写出两点:
①
②
(3)如果用分析天平准确称取0.51g镁铝合进行实验,测得生成气体体积为560 mL(已折算成标况下体积),请计算合金中镁的质量分数。(请写出计算过程)___________ ____________________________________________________________________________。
[探究二] 实验方案:称量Bg另一品牌铝镁合金粉末.放在如下图所示装置的惰性电热板上,通电使其充分灼烧。 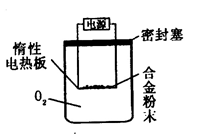
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是 。
(2)用本方案进行实验时,装置中至少要充入O2的物质的量 mol(用含B的最简式表示)。
[实验拓展] 研究小组对某无色透明的溶液进行实验,发现该溶液跟铝反应时放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-,在下列两种情况下,可能存在于此溶液中的是:
①当与铝反应后生成Al3+时,原溶液可能大量存在的离子 。
②当与铝反应后生成[Al(OH)4]-时,原溶液可能大量存在的离子是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com