
题目列表(包括答案和解析)
下列A、B两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
(12分)
A.分子式为Pt(NH3)2Cl2的配位化合物有顺铂和反铂两种同分异构体。顺铂的结构式为 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为 ,无抗癌作用。
,无抗癌作用。
⑴ C、N、O三种元素的电负性由大到小的顺序是 ▲ ;Ni元素与Pt元素位于同一族,写出Ni元素基态原子的电子排布式: ▲ 。
⑵ 顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由: ▲ 。
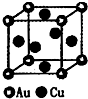
⑶ 金属铂的原子堆积方式为与铜型(面心立方堆积),一个金属铂的晶胞中含有 ▲ 个铂原子。
⑷ NH3还能与很多化合物通过配位键发生相互作用。例如:科学家潜心研究的一种可作储氢材料的化合物 X是NH3与第二周期另一种元素的氢化物相互作用的产物,X是乙烷的等电子体;加热化合物 X会缓慢释放H2,转变为化合物Y,Y是乙烯的等电子体。
① 化合物X的结构式为 ▲ (必须标明配位键)。
② 化合物X、Y分子中,N元素分别发生了 ▲ 杂化。
 ,具有抗癌作用;反铂的结构式为
,具有抗癌作用;反铂的结构式为 ,无抗癌作用。
,无抗癌作用。(A)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。![]() 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O![]() NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成![]() 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试回答下列问题:

(1)基态氮原子核外电子排布的轨道表示式为_____________。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为_____________。
(3)HN3属于_____________晶体,![]() 的空间构型是_____________,与
的空间构型是_____________,与![]() 互为等电子体的分子的化学式为_____________(写1种)。
互为等电子体的分子的化学式为_____________(写1种)。![]() 的电子式为____________,其中心原子的杂化类型是____________。
的电子式为____________,其中心原子的杂化类型是____________。
(4)![]() 中的键型为___________,超导氧化物A的化学式为___________。
中的键型为___________,超导氧化物A的化学式为___________。
(5)治癌药物B的结构简式为___________。
(B)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺。已知:反应(Ⅰ)的化学方程式为:FeSO4·7H2O+2NH4HCO3![]() FeCO3↓+(NH4)2SO4+CO2↑+H2O
FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KCl![]() K2SO4+2NH4Cl
K2SO4+2NH4Cl
工艺流程如下:

试回答下列问题:
(1)该工艺中的副产品是____________。(填化学式)
(2)操作C的名称为____________。
(3)原料绿矾、碳酸氢铵的最佳投料比是____________(质量比)时,FeSO4的转化率大于95%。
(4)物质甲是____________(填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700—
31 |
30 |
| 2 |
| 3 |
A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,E 是地壳中含量最高的金属元素。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是_________,E离子的电子排布式为____________,C原子的电子排布图为 ,D原子的原子结构示意图为_______ 。
(2)B的氢化物的沸点高于同主族元素氢化物的沸点,原因是_____________,该氢化物的电子式为_______,中心原子的杂化方式为 _______,分子的立体构型为_______。
(3)DCA与E的最高价氧化物的水化物相互反应的离子方程式 。
(4)根据对角线规则,Be与E性质相似,写出Be与DCA溶液反应的离子方程式______________________
(5)若要说明非金属元素X比元素Y(X、Y均为非稀有气体元素)的非金属性强,则下列方法正确的是__________(填序号)。
①X单质可以把Y从其氢化物中置换出来
②X原子的最外层电子数比Y原子的最外层电子数多
③X的氧化物的水化物的酸性比Y的氧化物的水化物的酸性强
④与H2化合时X单质比Y单质容易
⑤电负性:X>Y
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com