
题目列表(包括答案和解析)

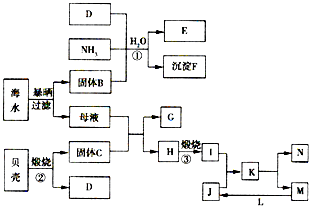 [化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
[化学与技术]海洋是巨大的资源宝库,从海洋中我们可以获得各种各样的化学物质,下图是综合利用海洋资源的一个例子(假设海水中存在的离子主要有Na+、Mg2+、Cl-).
| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
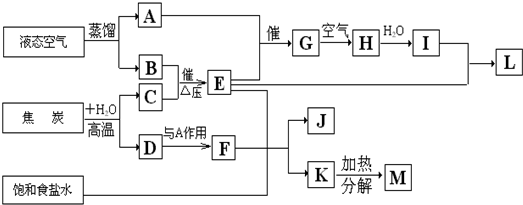
 以海水中常见物质A为原料可以发展很多工业,图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题.
以海水中常见物质A为原料可以发展很多工业,图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题.
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com