
题目列表(包括答案和解析)
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
|
| 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:
(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。
反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
| | 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
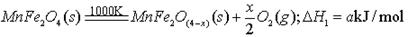
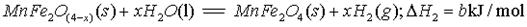
 (填字母编号)。
(填字母编号)。 B.物料可循环使用
B.物料可循环使用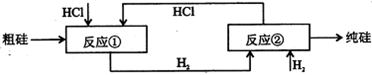
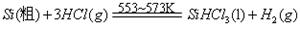
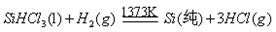
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH如右表所示。
|
|
开始沉淀 |
完全沉淀 |
|
Fe3+ |
2.7 |
4.2 |
|
Mn2+ |
8.3 |
10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:


(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。

反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
【化学——选修:化学与技术】 ( 15分)
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图如下:
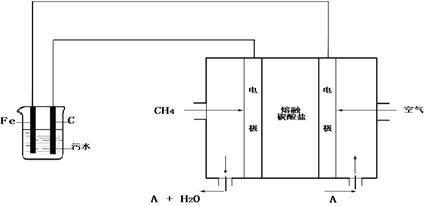
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的 ;
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.C H3CH2OH
(2)电解池阳极的电极反应分别是:① ;
②4OH-- 4 e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 ;
(4)该熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,
稀土金属材料为电极。已知负极的电极反应是CH4+4CO32-- 8e-=5CO2+2H2O。
①正极的电极反应是 ;
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是 ;
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4
(标准状况) L。
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com