
题目列表(包括答案和解析)
| 9 | 10 |
研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)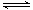 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2
(g)+3H2(g)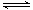 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
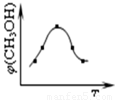
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
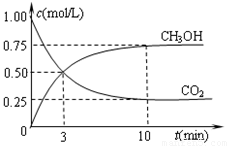
②在容积为1L的恒温密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。
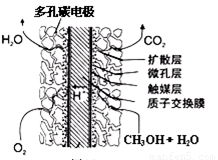
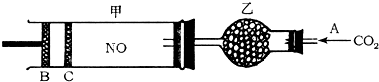
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2 (g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。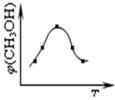
②在容积为1L的恒温密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。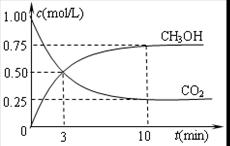
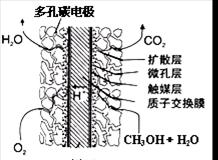
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。 CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3


 (2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示.
(2012?百色二模)在2L的密闭容器内投入一定量NO2,发生反应2NO2(g)?2NO(g)+O2(g).分别在a、b两种不同实验条件下反应,得出NO2的浓度随时间变化的曲线如图所示.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com