
题目列表(包括答案和解析)
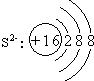
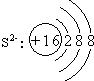


| ||
| ||
原子序数依次增大的A、B、C、D都是元素周期表中前20号元素,B、C、D同周期,A、D同主族,且A的原子结构中最外层电子数是电子层数的3倍。D的最高价氧化物对应的水化物为强酸,且B、C、D的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。根据以上信息,回答下列问题:
(1)D的离子结构示意图是 ,A和B形成的化合物中含有非极性共价键的是 ,该物质的电子式是 。
(2)加热时,D单质能跟B的最高价氧化物对应水化物的浓溶液发生氧化还原反应,生成两种盐,该氧化还原反应的离子方程式为 。
(3)写出C的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物反应的离子方程式 。
(8分)原子序数依次增大的A、B、C、D四种短周期元素。元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D所在周期的各元素单质沸点变化如图I(原子序数按递增顺序连续排列)。B、C、D三种元素均能与A形成等电子的三种分子,且化合物中各原子的个数比为:
| 化合物 | 甲 | 乙 | 丙 |
| 原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶2 |
原子序数依次增大的A、B、C、D、E、F六种短周期元素①原子半径由大到小顺序是D>E>F>B>C>A②E是同周期中离子半径最小的元素,F是同周期中原子半径最小的元素③B的最高价氧化物的水化物和氢化物反应生成盐④C和D可以形成1:1和1:2的两种常见化合物。
回答:
①C和D生成1:1的化合物的电子式: 。
②用电子式表示A和B形成的化合物的形成过程
③E的电高价氧化物水化物和B的最高价氧化物的水化物反应的离子方程式
④F的单质和强碱反应的离子方程式为
⑤A、C、D、E、F的简单离子的半径由大到小的顺序是(用元素的离子符号表示)
⑥用离子方程式说明B与A形成的氢化物结合H+能力强于C与A形成的氢化物:
一.单项选择
1.D 2.A 3.B 4.B 5.D 6.C 7.B 8.A
二.不定项选择
9.A 10.BC 11.AD 12.AC 13.CD 14.B 15.C 16.D
三.(本题包括2小题,共22分)
17.①③⑤⑦(6分) 说明:漏选、错选一个均扣2分,扣完为止
18.⑴分馏(或蒸馏)(2分)
⑵①浓硫酸(1分) 使滴入烧瓶中的SiHCl3气化(2分)
②有固体物质生成(1分) 在1000~1100℃的反应温度下,普通玻璃会软化(1分)
SiHCl3+H2Si+3HCl(3分)
③排尽装置中的空气(2分)
④将试样用稀盐酸溶解,静置取上层清液,加入氯水后再滴加几滴KSCN溶液,观察是否有红色溶液生成。(4分)
说明:只要方案设计简单,现象明显,合理均可得分。
四.(本题包括2小题,共19分)
19.⑴第三周期第VIA族(2分)
⑵C3N4(2分) 大于(1分)
⑶2Al+2OH-+2H2O=2AlO2-+3H2↑(3分)
20.⑴NaCl(2分)
⑵降低X、Y熔化时的温度,节约能源(2分)
⑶用作干燥剂(1分)
⑷2Cl2+Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(3分)
2Na2O2+2H2O=4NaOH+O2(3分)
五.(本题包括1小题,共9分)
21.⑴ <(3分)
⑵2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g);ΔH=-3121.6KJ/mol (3分)
⑶越少(3分)
六、(本题包括2小题,共18分)
22.⑴(2分)
⑵(2分)
(2分)
⑶ (1分) (1分)
23.⑴NaOH溶液、△(2分) 浓硫酸 、△(2分)
⑵A: (2分) F: (2分)
⑶2+O22 +2H2O(2分)
七、(本题包括2小题,共18分)
24.⑴1:1(2分)
⑵0.71(3分)
⑶6g(3分)
25.⑴2.75mol/L(3分)
⑵0(3分)
解析:设12.8g的样品中CuS的物质的量为x ,Cu2S的物质的量为y
96x+160y=12.8
8x/3+10y/3=0.3
解得:x=y=0.05mol
根据方程式①、②可知消耗n(H+)=0.05mol×8/3+0.05mol×16/3=0.4mol
故剩余n(H+)=0.1mol,c(H+)=1mol/L pH=0
⑶11.2L(4分)
解析:首先判断64g样品中CuS、Cu2S的物质的量为0.25mol
本题采用极端假设:
若HNO3均与CuS反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
若HNO3均与Cu2S反应:硝酸不足,则V(NO)=0.5mol×22.4L/mol=11.2L
所以:c中产生气体体积(V)等于11.2L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com