
题目列表(包括答案和解析)
能源、可划分为一级能源和二级能源。自然界中以现成形式提供的能源,击。煤、石油、天然气称为一级能源需依靠其他能源的能量间接制取的能源称为二级能源。煤、石油、天然气等是多年来大规模使用的能源,称为常规能源,属于不可再生的化石能源。一些著名的地质专家预测,石油产量最早可能在2010年,最迟在2037年达到顶峰。此后就会不可逆转地下降,而石油和天然气的价格将大幅上升,且难以回落。
煤、石油、天然气等化石燃料燃烧后会放出多种污染大气的化学物质以及二氧化碳等温室气体,而氢燃料电池源源不断地提供能量的同时排出的只有水。
美国加州理工学院的研究员在美国《科学》上撰文指出,氢燃料系统未必对环境完全无害。氢比空气轻得多,很容易向空中运动。研究员们估计完全使用氢燃料将导致进入大气同温层的氢分子增加到目前的3倍。同温层距地面15-40km,包含臭氧层,氢分子进入同温层会被氧化成水。
发展氢燃料系统的主要提倡者杰里米?里夫金说:“当转而利用一种新能源的时候,你必然设想它可能产生一些环境影响,但是氢作为化石燃料的替代物,依然是我们未来的希望。”
发展氢能源需要解决如何廉价地制备大量氢气,以及如何安全贮存、运输氢气等问题。从化石原料制取氢气,已经有比较成熟的技术及工业装置,并在不断研究改进之中,所制得的氢气主要作为化工原料,如合成氨、合成甲醇及油品等。但从化石原料制取氢气的过程必然会放出二氧化碳,因此不能解决温室气体的排放问题。非化工原料制氢主要是指从含氢物质制取氢气,其中水电解制氢技术已成熟并有工业生产装置,但电能消耗较大(每立方米氢气耗电约4~5kw-h),目前尚受到一定的限制。但从水中制氢是理想的制氢方法。
【思考】阅读以上文摘,并注意带有下划线的文字,完成下列填空。
(1)理想的制氢方法是 ,此过程是 (填写“释放”或“消耗‘)能量的过程。氢气是一种高效而又没有污染的 级能源。
(2)水电解制氢反应的化学方程式是 。
(3)关于用水制取氢气,以下研究方向不正确的是
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找特殊化学物质,用于开发廉价能源,以分解水获得氢能源
(4)作为能源,氢气具有其他能源所不具备的优点。第一,燃烧时放出的热量多,放出的热量约为同质量汽油的3倍。第二 。第三最大的优点是 。氢气的重量轻、密度小,便于运送和携带,容易储藏,与难储存的电相比,优越性更为显著。
能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是 ;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应b:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为 ;
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是 ;(填字母代号)

A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式 ;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式 。
能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜
[Cu(NH3)2Ac]溶液(Ac=CH3COO-)(来吸收合成气中的一氧化碳,其反虚原理为:
[Cu(NH3)2Ac](aq)+CO+NH3 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0)
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是 ;
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应b:CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①对于反应a,某温度下,将4.0 mol CO2(g)和12.0 mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为 ;
②对于反应b,某温度下,将1.0mol CO(g)和2.0 mol H2(曲充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,温度和压强的关系判断正确的是 ;(填字母代号)
A.p3>p2,T3>T2
B.p2>p4,T4>T2
C.p1>p3,T1>T3
D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g) CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 ;
A.逆反应速率先增大后减小
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式 ;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式 。
 [Cu(NH3)3]Ac?CO(aq)(△H<0)
[Cu(NH3)3]Ac?CO(aq)(△H<0) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol CH3OH(g) △H<0
CH3OH(g) △H<0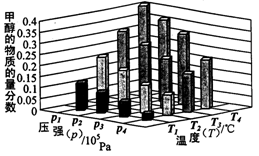
 CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0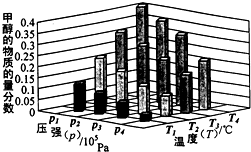 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com