
题目列表(包括答案和解析)
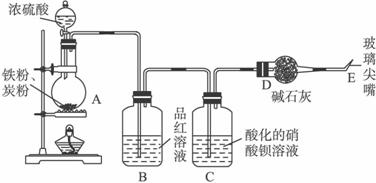
(1)在未点燃酒精灯前,该同学观察到B中没有出现明显的现象,这是因为_____________;点燃酒精灯后,烧瓶内可能发生的化学反应为:
2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O
Fe2(SO4)3+3SO2↑+6H2O
C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
随着反应的进行,还可能发生其他反应,试写出其中两个反应的离子反应方程式:________
____________________________________________________________________。
(2)当反应进行一段时间后,在C瓶中观察到有白色沉淀产生,该沉淀是_______(填化学式),在点燃E处产生的气体之前要先进行验纯,请简述操作及有关现象______________。
(3)在烧瓶中加入碳粉,可以使E处产生气体的速率加快,原因是:________________。
(4)反应结束后,安装好过滤装置。先用少量热水通过过滤器,以提高它的温度,然后将烧瓶中的溶液趁热过滤。将滤液转入试管中,用橡皮塞塞住管口,静置、冷却,可以看到硫酸亚铁晶体在试管中结晶析出。将析出的晶体过滤、干燥、称重,得硫酸亚铁晶体
已知:硫酸亚铁晶体在受热时发生的反应为:
2FeSO4·xH2O![]() Fe2O3+SO2↑+SO3↑+2xH2O。请回答:
Fe2O3+SO2↑+SO3↑+2xH2O。请回答:
①提高过滤器温度的目的是__________________;
②用橡皮塞塞住管口是为了_________________;
③求该晶体中所含结晶水的个数(要求写出计算过程)。
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
| 实验步骤 | 实验现象 |
| ①将一小块金属钠投入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过)分别投入足量的相同体积0.5mol?L-1盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol?L-1盐酸和3mol?L-1盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
| ① | ② | ③ | ④ | |
| I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| II | 碱石灰 | 氯化钙 | 硅胶 | 氯化钠 |
| III | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com