
题目列表(包括答案和解析)
| 1 |
| 2 |
| 1 |
| 2 |
(5分)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,表示乙硼烷燃烧热的热化学方程式为______ __________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
(3分) 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态二氧化二碳和液态水,放出649.5kJ热量,其热化学反应方程式为 :
又知H2O(l)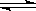 H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 J。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 J。
已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式_ 。则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com