
题目列表(包括答案和解析)
对一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行
综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题.
(1)关于反应物之间的定量关系的研究:
已知反应:Br2+2Fe2+![]() 2Br-+2Fe3+,向10 mL 0.1 mol·L–1的FeBr2溶液中通入0.001 mol Cl2,该反应的离子方程式为:________
2Br-+2Fe3+,向10 mL 0.1 mol·L–1的FeBr2溶液中通入0.001 mol Cl2,该反应的离子方程式为:________
(2)关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×1012,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg2+)=________.
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.10 mol水蒸气,发生反应:
2H2O(g)![]() 2H2(g)+O2(g);ΔH=+484 kJ·mol-1
2H2(g)+O2(g);ΔH=+484 kJ·mol-1
不同时段产生O2的量见下表:
![]()
则前20 min的反应速率v(H2O)=________;
达平衡时,至少需要吸收的光能为________kJ.
③向某密闭容器中加入0.3 molA、0.1 molC和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示.附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件,所用条件均不同.已知,t3-t4阶段为使用催化剂[已知t0-t1阶段c(B)未画出].请回答:
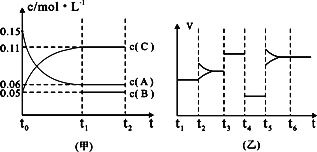
Ⅰ:t4-t5阶段改变的条件为________,
Ⅱ:B的起始物质的量为________.
对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反应:Br2 +2Fe2+=2 Br -+2Fe3+,向10mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=
②科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
2 H2O(g)
2 H2 (g) + O2(g) △H=+484kJ· mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
则前20min的反应速率v(H2O)= ;达到平衡时,至少需要吸收的光能为 kJ。
③向某密闭容器中加入0 .3molA、0 .1molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示。附图中乙图为t2时刻后改变容器中条件,平衡体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件。已知t3~t4为使用催化剂,甲图中t0~t1阶段c (B)未画出。请回答:
Ⅰ:t4~t5阶段改变的条件是 t5~t6阶段改变的条件是
Ⅱ:B的起始浓度为 ,该反应方程式为
在体积固定的密闭容器中,进行如下化学反应:N2O4(g)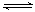 2
NO2(g),其化学平衡常数K和温度t的关系如下表:
2
NO2(g),其化学平衡常数K和温度t的关系如下表:
|
t /℃ |
80 |
100 |
120 |
|
K |
1.80 |
2.76 |
3.45 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)判断该反应达到化学平衡状态的依据是 。
A.容器内混合气体密度不变
B.混合气体中c(NO2)不变
C.0.5mol N2O4分解的同时有1 mol NO2生成
(4)在80℃时,将2.80molN2O4气体充入2L固定容积的密闭容器中,一段时间后对该容器内的物质进行分析,得到如下数据:
|
|
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
2.80 |
A |
2.00 |
c |
d |
1.60 |
|
n(NO2) |
0 |
0.96 |
b |
2.08 |
2.40 |
2.40 |
①b的值为 ;
②N2O4的平衡转化率为 ;
③20s~40s内用N2O4表示的平均反应速率υ(N2O4)= 。
在体积固定的密闭容器中,进行如下化学反应:N2O4(g) 2NO2(g),其化学平衡常数K和温度t的关系如下表:
2NO2(g),其化学平衡常数K和温度t的关系如下表:
| t /℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
  | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | A | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
 2NO2(g),其化学平衡常数K和温度t的关系如下表:
2NO2(g),其化学平衡常数K和温度t的关系如下表:| t /℃ | 80 | 100 | 120 |
| K | 1.80 | 2.76 | 3.45 |
  | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 2.80 | A | 2.00 | c | d | 1.60 |
| n(NO2) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com