(2012?许昌三模)碳及其化合物的研究具有重要的现实意义.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
3
3
C+
2
2
K
2Cr
2O
7+
8
8
H2SO4
H2SO4
→
3
3
CO
2↑+
2
2
K
2SO
4+
2
2
Cr
2(SO
4)
3+
8
8
H
2O
请完成并配平上述化学方程式.
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H
2(g)?CH
3OH(g).
下表所列数据是在不同温度下的化学平衡常数(K)
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.0 |
0.27 |
0.012 |
①在一定条件下将2mol CO和6mol H
2充入2L的密闭容器中发生反应,5分钟后测得c(CO)=0.4mol/L,算此段时间的反应速率(用H
2表示)
0.24
0.24
mol/(L?min);
②由表中数据判断上述合成甲醇反应的△H
<
<
0(填“>”、“<”或“=”)
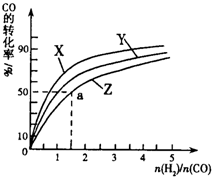
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H
2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系请回答:
(Ⅰ)在上述三种温度中,曲线Z对应的温度是
270℃
270℃
;
(Ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H
2(g)?CH
3OH(g)的平衡常数K=
4L2?mol-2
4L2?mol-2
.
④一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳.写出该电池负极发生反应的电极方程式
CH3OH+H2O═CO2+6H++6e-
CH3OH+H2O═CO2+6H++6e-
.
(3)CO
2在自然界循环时可与CaCO
3反应,CaCO
3是一种难溶物质,其K
sp=2.8×10
-9.CaCl
2溶液与Na
2CO
3溶液混合可形成CaCO
3沉淀,现将等体积的CaCl
2溶液与Na
2CO
3溶液混合,若Na
2CO
3溶液的浓度为7×10
-4 mol/L,则生成沉淀所需CaCl
2溶液的最小浓度为
1.6×10-5mol/L
1.6×10-5mol/L
.


 CaCO3
CaCO3  2MgO+C
2MgO+C 
 CH3OH(g)。某研究小组将2 mol
CH3OH(g)。某研究小组将2 mol 