
题目列表(包括答案和解析)
把50mL 2mol/L NaOH溶液、100mL 1mol/L H2SO4溶液与17mL 10%氨水(密度为0.96g/mL)混合,则所得的溶液中离子浓度大小的正确顺序为
[ ]
A.c(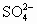 )>c(Na+)>c(
)>c(Na+)>c(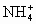 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.c(Na+)>c(NH4+)>c(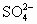 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.c(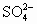 )=c(Na+)>c(H+)>c(
)=c(Na+)>c(H+)>c(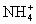 )>c(OH-)
)>c(OH-)
D.c(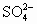 )=c(Na+)>c(
)=c(Na+)>c(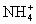 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
 实验室要配制0.5mol/L的NaOH溶液100mL,则:
实验室要配制0.5mol/L的NaOH溶液100mL,则: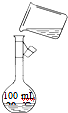
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com