
题目列表(包括答案和解析)
 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)| 催化剂 | △ |
(一)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
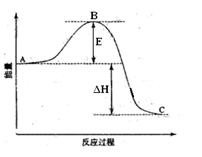
(1)图中E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
(2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:
(3)计算由S(s)生成3 molSO3(g)的△H
(二)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__ NaOH+ __Cl2 → __Na2FeO4+ __NaNO3 + __NaCl + __H2O
(1)配平上述反应,当生成3mol还原产物时,转移电子的总数为 mol;
(2)铁酸钠除了能消毒外,还可以用于净水,原因是
(一)(6分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
(2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:
(3)计算由S(s)生成3 molSO3(g)的△H
(二)(6分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__NaOH+ __Cl2 → __Na2FeO4+ __NaNO3 +__NaCl + __H2O
(1)配平上述反应,当生成3mol还原产物时,转移电子的总数为 mol;
(2)铁酸钠除了能消毒外,还可以用于净水,原因是
(一)(6分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题: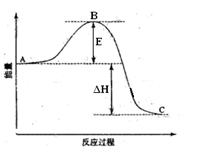
 (1)图中E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
(1)图中E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?  (2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:
(2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:  (3)
(3)
 计算由S(s)生成3 molSO3(g)的△H
计算由S(s)生成3 molSO3(g)的△H
(二)(6分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__ NaOH+ __Cl2 → __Na2FeO4+ __NaNO3 + __NaCl + __H2O
(1)配平上述反应,当生成3mol还原产物时,转移电子的总数为 mol;
(2)铁酸钠除了能消毒外,还可以用于净水,原因是
(一)(6分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:

(1)图中E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?
 (2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:
(2)已知单质硫16g燃烧放热为149 KJ写出硫燃烧热的热化学方程式:
(3) 计算由S(s)生成3 molSO3(g)的△H
计算由S(s)生成3 molSO3(g)的△H
(二)(6分)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__Fe(NO3)3 +__ NaOH+ __Cl2 → __Na2FeO4+ __NaNO3 + __NaCl + __H2O
(1)配平上述反应,当生成3mol还原产物时,转移电子的总数为 mol;
(2)铁酸钠除了能消毒外,还可以用于净水,原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com