
题目列表(包括答案和解析)
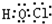
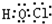
(1)D在元素周期表中的位置是____________。
(2)E离子的结构示意图为____________。
(3)C2的电子式为____________,在E2D2中含有的化学键类型有____________。
(4)由A、B、C、D四种元素组成的离子化合物的化学式为(写出一种即可)____________。
(1)其原子半径大小关系是:D>E>B>C>A;
(2)A、D同主族并可形成离子晶体DA;
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。 请填写下列空白:
①B、E两者的最高价氧化物对应的水化物反应后所得产物的溶液的pH________7(填“>”“<”或“=”);
②D
③1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生______mol A2气体,并写出其反应的离子方程式________________;
④BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为_______________。
(1)其原子半径大小关系是:D>E>B>C>A。
(2)A、D同主族,并可形成离子晶体DA、
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。
请填写下列空白:
(1)DA与水反应后所得溶液的pH_________(填“>”“<”或“=”)7。
(2)D
(3)1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生_________mol A2气体,并写出其反应的离子方程式__________________。
(4)写出B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水的离子方程式:
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
(5)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为___________________________。
A、B、C、D、E五种短周期元素的原子序数依次增大,且知:
(1)其原子半径大小关系是:D>E>B>C>A。
(2)A、D同主族,并可形成离子晶体DA、
(3)B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。
(4)B、E两种元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和。
请填写下列空白:
(1)DA与水反应后所得溶液的pH_________(填“>”“<”或“=”)7。
(2)D2C2的电子式__________________。
(3)1 mol E单质与足量的D的最高价氧化物的水化物溶液反应,能产生_________mol A2气体,并写出其反应的离子方程式__________________。
(4)写出B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水的离子方程式:
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
_____________________________________________________。
(5)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为___________________________。
第Ⅰ卷 (选择题共48分)
一、单项选择题:(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1、C 2、B 3、B 4、A 5、C 6、A 7、D 8、D
二、不定项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
9、D 10、BC 11、AD 12、A 13、C 14、B
第Ⅱ卷 (选择题共72分)
三、(本题包括1小题,共10分)
15.(10分) 每空2分
I AB
II(1)SiO2 (2)保持较大的C2O42-离子浓度,使Ca2+沉淀完全。
(3)降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差。
(4) 或
或 %
%
四、(本题包括2小题,共18分)
16.(8分)
(1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ?mol-1 (2分)
2SO3(g) △H=-196.6 kJ?mol-1 (2分)
 (3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)错误!链接无效。
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)错误!链接无效。
17.(10分)
(1) (2分)
(2)8Al+3Fe3O4 4Al2O3+9Fe (2分)
4Al2O3+9Fe (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)③ (2分)
五、(本题包括1小题,共10分)
18.(10分)(每空2分)
 (1) ③⑤
(1) ③⑤
(2)
(3) ①如2Na+2H2O=2Na++2OH-+H2↑;
②如CH3COOH+NH3×H2O=CH3COO-+NH4++H2O;
③如Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
六、(本题包括1小题,共12分)
19.( 12分)每空2分
12分)每空2分
⑴过滤 低温蒸发结晶
⑵(如图或其他能防止氨气倒吸的装置)
⑶ 冷凝管
⑷ ① 2CaSO4
2CaO+2SO2↑+O2↑
2CaSO4
2CaO+2SO2↑+O2↑
② 95.6%
七、(本题包括1小题,共8分)
20.(8分)
解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol
n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (2分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (2分)
八、(本题包括1小题,共14分)
21.(14分)
(1)相同 b (每空1分)
(2)B(2分)
(3)I.3d24S2 (2分) II.[TiCl(H2O)5]Cl2?H2O(2分)
(4)I.KO2 kJ?mol-1 (每空2分,共
射阳中学2009届高三上学期第二次月考
化 学 答 题 纸
三、(本题包括1小题,共10分)
15.(10分)
I
II(1)
(2)
(3)
(4)
四、(本题包括2小题,共18分)
16.(8分)
(1)
(2)
(3)
(4)
17.(10分)
(1)
(2)
(3)
(4)阳极 阴极
五、(本题包括1小题,共10分)
18.(10分)
(1)
(2) 
(3) 请在下列表格中用相应的“离子方程式”否定这些观点。
①所有的离子方程式均可以表示一类反应
②酸碱中和反应均可表示为:H++OH-=H2O
③离子方程式中凡是难溶性酸碱盐(产物)均要用“↓”
六、(本题包括1小题,共12分)
19.(12分)
(1)
(2) 
(3)
(4)①
②
七、(本题包括1小题,共8分)
20.(8分)
(1)
(2)
(3)
八、(本题包括1小题,共14分)
21.(14分)
(1)
(2)
(3)I II
(4) I II
 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com