
题目列表(包括答案和解析)
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
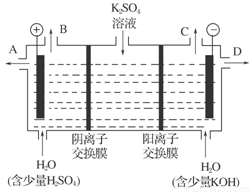
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
(8分)(2011·济南一模)海水中蕴藏着丰富的资源,人类需要的很多材料都来源于海水的综合利用。
(1)工业上用NaCl制备金属钠的化学方程式是____________________________________
________________________________________________________________________。
(2)实验室用惰性电极电解100 mL 0.1 mol·L-1 NaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为________(忽略反应前后溶液的体积变化)。
(3)电解氯化钠溶液可制备“84消毒液”(主要成分是次氯酸钠),通电时氯气被溶液完全吸收。假设所得的消毒液仅含一种溶质,请写出相应的总化学方程式________________________________________________________________________。
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。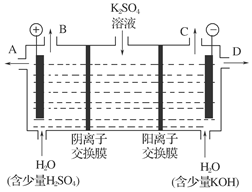
①该电解槽的阳极反应式为:_______________________________________________;
通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”或“D”)________导出。
③请简述通电开始后,阴极附近溶液pH变化的原因:____________________。
④若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃烧电池,则电池正极的电极反应式为_______________________________________________________。
Ⅰ下列说法不正确的是____ 。
A.可以利用某些炼钢废渣来生产磷肥
B.具有永久硬度的水主要用加热的方法来进行软化
C.硫酸工业中,在接触室安装热交换器是为了利用S03转化为H2S04时放出的热量
D.合成氨工业原料气净化时,常用碳酸钾溶液吸收除去二氧化碳
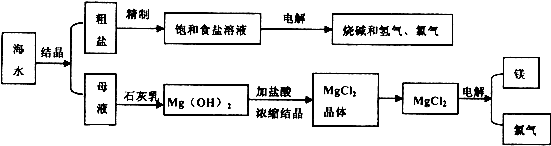
Ⅱ下图是某工厂对海水资源进行综合利用的示意图。

请回答下列问题:
(1)用离子交换膜电解饱和食盐水时,精制的饱和食盐水应该加入到 极室。
(2)已知在离子交换膜电解槽中,理论上每小时通过1安培的直流电,每槽可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342×103 kg/m3)113 m3,电解槽的电流强度1.45×l04 A,该电解槽的电解效率为 。
(3)示意图中制取NaHC03的化学方程式为 。
(4)有人提出直接加热Mg(OH)2得到Mg0,再电解熔融Mg0得金属Mg,这样可简化流程。请判断该方案是否可行,并说明理由 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com