
题目列表(包括答案和解析)
![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.在大试管中加入5.10 mL 1 mol·L-1 HCl,再加入1 mL水玻璃,然后用力振荡,可制得硅酸溶胶
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(![]() )=c(Cl-)
)=c(Cl-)
D.pH=13的NaOH溶液与pH=1的CH3COOH溶液等体积混合后所得溶液的pH>7
(09盐城第三次调研)孔雀石的主要成分是Cu(OH)2?CuCO3 (其杂质主要为FeCO3等),它用于制于胆矾的实验步骤如下:
①在100 mL烧杯中加入3 mol?L-1稀硫酸12 mL,加热,少量多次加入5~10 g孔雀石粉,控制硫酸铜溶液的pH约为1.5~2.0,并加水稀释至35 mL左右。
②滴加约4 mL 3% H2O2,待滴加完后,用2 mol? L-1 NaOH溶液调节溶液的酸度,控制pH值为3.0~3.5,将溶液加热至沸数分钟,趁热过滤。
③水浴加热,蒸发结晶
④重结晶
试回答下列问题:
(1)步骤①中为什么要少量多次加入孔雀石粉? ;用硫酸浸取的化学方程式: 。
(2)pH值控制为3.0~3.5,其目的是: ;加过氧化氢发生反应的离子方程式为: 。
(3)为什么必须水浴加热及怎样判断蒸发浓缩已完成: 。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重计录如下表: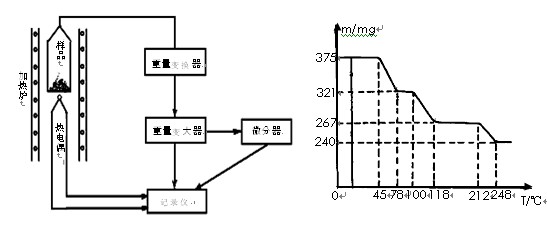
写出212-250℃温度范围内发生反应的化学方程式: 。
下列说法不正确的是( )
A.0.2 mol?![]() 的
的![]() 溶液中:[
溶液中:[![]() ]>[
]>[![]() ]>[
]>[![]() ]>[
]>[![]() ]
]
B.在大试管中加入5.10 mL 1mol?![]() HCl,再加入1 mL水玻璃,然后用力振荡,可制得硅酸溶胶
HCl,再加入1 mL水玻璃,然后用力振荡,可制得硅酸溶胶
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:[![]() ]=[
]=[![]() ]
]
D.pH=13的NaOH溶液与pH=1的![]() 溶液等体积混合后所得溶液的pH>7
溶液等体积混合后所得溶液的pH>7
 (1)有右图所示A、B、C、三种仪器:请写出三种仪器的名称A
(1)有右图所示A、B、C、三种仪器:请写出三种仪器的名称A

| ||
| ||
1
2
3
4
5
6
7
8
D
B
C
A
C
D
D
C
9
10
11
12
13
14
╆╆╆╆╆
╆╆╆╆╆
CD
D
D
CD
B
AD
~~~~~
~~~~~
15.每空均2分,共10分
(1)吸附水中有色物质(脱色);(2)S2-+H2O2=S+2OH―(或:S2-+H2O2+2H+=S↓+2H2O);(3)将水样可能含有的高铁离子及铬酸盐还原;(4)偏低
(5)V1×2c×35.5×1000/V=71000CV1/V
16.(8分)
(1)第三周期第VIIA族 (2分)
(2) 2SO2(g)+O2(g) 2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
2SO3(g)
△H=-196.6 kJ?mol-1 (2分)
(3)Al3++3AlO2-+6H2O=4Al(OH)3↓ (2分) (4) H2O (2分)
 |
17.(10分)
(1) (2分)
(2)2FeCl2+Cl2===2FeCl3 (2分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)阳极:6O2--12e-=3O2↑;阴极:4Al3++12e-=4Al (每空1分)
(5)错误!未找到引用源。 (2分)
18.⑴S2- + H2O HS- +OH- HS- + H2O
HS- +OH- HS- + H2O H2S +OH-(可不写)
H2S +OH-(可不写)
⑵2.7×10-3 ⑶172.5 ⑷使BaSO4得到充分的还原(或提高BaS的产量)
①②为吸热反应,炭和氧气反应放热维持反应所需高温
19.(12分)
(1)D(2分)
(2)Cu(1分)
(3)H2(1分);①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大,②该反应放热,升高温度反应加快,③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
(5)A(1分),电解质性质(合理解答同样给分)(1分)
20.(共10分)
(1)解: 2SO2(g) + O2(g)  2SO3(g)
2SO3(g)
起始浓度/ mol?L-1 0.050 0.030 0
平衡浓度/ mol?L-1 (0.050-0.040) (0.030-0.040/2) 0.040
= 0.010 = 0.010
所以,K = =
=  = 1.6×103 mol?L-1。(不带单位计算也得分)
= 1.6×103 mol?L-1。(不带单位计算也得分)
(SO2)
= ×100%
= 80% 。
×100%
= 80% 。
(2)B、C。 (3)SO2+H2O+Na2SO3=2NaHSO3。
(4)抑制Fe2+、Fe3+的水解,防止Fe2+被氧化成Fe3+。
21.(12分)
解:(1)6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O (2分)
(2)n(Fe)=×2=0.035 mol n(SO42-)==0.045 mol
n(OH-)=3×n(Fe3+)-2×n(SO42-)=3×0.035 mol-2×0.045 mol=0.015 mol (3分)
盐基度=×100%= ×100%=14.29% (2分)
(3)n(H2O)=
=0.054 mol
化学式: Fe35(OH)15(SO4)45?54H2O (3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com