
题目列表(包括答案和解析)

过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5 mol·L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为
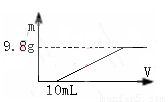
A.0.05mol B.0.1mol
C.0.2mol D.0.25mol
(12分)某研究性小组进行如下实验:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?__________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____ 0.2mol/L(填﹥、﹤或=)。混合液中离子浓度c(A-) c(Na+)(填﹥、﹤或=)。
(3)从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是_____ ___。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
下列各种溶液粒子物质的量浓度关系正确的是()
A.0.1mol·V的NH4Cl溶液与0.05mol·L-1的NaOH溶液等体积混合:c(Cl-)>c(Na+)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.0.2mol·L-1Na2CO3溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
C.0.2mol·L-1(NH4)2SO4溶液:c(![]() )>c(
)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D.0.2mol·L-1NaHCO3溶液:c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)
)>c(OH-)
300mLAl2(SO4)3溶液中,含Al3+1.62g,在该溶液中加入0.1mol/L的Ba(OH)2溶液300mL,反应后溶液中SO42-的物质的量浓度为( )
A. 0.4mol/L B.0.3mol/L C. 0.2mol/L D. 0.1mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com