
题目列表(包括答案和解析)
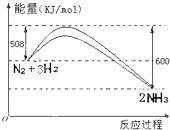 根据要求回答下列叙述相关问题
根据要求回答下列叙述相关问题| 3 |
| 2 |
| 1 |
| 2 |
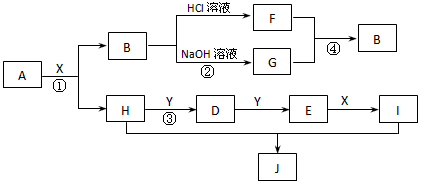

在真空中将一种晶体物质A加热到200℃时,即产生4种气体B、C、D、E,它们的物质的量之比为1∶1∶1∶1,冷却到0℃时生成另一种晶体物质K,此时4种气体中有一种没有参加反应,该气体相对氢气的密度为14。各物质之间有如图所示的转化关系,其中F、H为单质,其余为化合物,C为无色液体,G为淡黄色粉末状固体,E与H的相对分子质量相等。根据上述信息回答下列问题:
(1)写出A的化学式 。写出A的名称 。
(2)写出B分子的空间构型 ,写出G的电子式
(3)写出反应②的化学方程式 。
(4)写出物质K与足量的I溶液在加热的条件下反应的离子方程式:
生物参考答案
1、C 2、B 3、D 4、C 5、B 6、A
28.(14分,除1、4小题外,每空1分)
(1)DNA复制 转录 翻译 逆转录 (4分)
(2)c (3)间(S) (4)rRNA mRNA tRNA (5)细胞核
(6)tRNA(转运RNA) 氨基酸
(7)如下图:(各2分)

29.Ⅰ、(16分,每空2分)
(1)BbTt,雌雄同株异花,雌雄同株异花、雄株和雌株,9:3:4.
(2)bbTT,bbtt (3)bbTt,bbtt。
Ⅱ、(8分)(1)A(1分) D(1分)(2)1/2(1分) aaXBY(1分) Ⅱ-8(1分)
(3)2/3(1分) 1/8(1分) 7/24(1分)
30.(16分,每空2分)
(1)a (1分) 光反应(1分) (2)b ①色素的数量 ②五碳化合物的含量
(3)①a温度主要通过影响光合作用的酶的活性影响光合作用强度
b一定时间内,光合作用产生的氧气的量可反映光合作用的强度
②一定时间内光合作用产生的O2气泡数
|