
题目列表(包括答案和解析)
(8分)(1)在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大原因。经检测某工厂废液中含有大量Mg2+、Al3+、Ag+,Fe3+、Ba2+。试分析回答下列问题:
①该废液中可能大量存在的一种阴离子是____(填序号)。
A.SO B.NO C.Cl- D.CO
②为了充分利用资源和保护环境,今要回收废液中的金属银,请你设计一个回收实验方案,并写出有关离子反应方程式: ____________________________________________
________________________________________________________________________。
(2)节能减排是中国政府报告中的关键词。火力发电厂为了减少二氧化硫的排放,往往对煤炭进行脱硫处理,而脱硫的方法有多种,下面是一种常用的脱硫方法:
微生物脱硫技术:煤炭中的硫是以FeS2存在的,在水和空气存在的条件下,脱硫微生物起生物催化作用:
①2FeS2+7O2+2H2O  4H++2Fe2++4SO42—;
4H++2Fe2++4SO42—;
②4Fe2++O2+4H+ 4Fe3++2H2O;
4Fe3++2H2O;
③FeS2+2Fe3+ 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O 4H++2SO42—。
4H++2SO42—。
在微生物脱硫的反应中,FeS2最终被________氧化,转化为________(填化学式)而除去;反应③中若生成0.2 mol S,则转移的电子为________mol。
(8分)(1)已知离子反应: +6I—+6H+=R—+3I2+3H2O,n=_____,R元素在
+6I—+6H+=R—+3I2+3H2O,n=_____,R元素在 中的化合价是___ __。
中的化合价是___ __。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: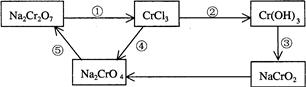
①在上述有编号的步骤中,需用还原剂的是_______,需用氧化剂的是 。 (填编号)。
②标出下面化学方程式电子转移的方向和数目(用双线桥表示),并回答有关问题
Na2Cr2O7+6KI+14HCl = 2CrCl3+2NaCl+6KCl+3I2+7H2O
反应中的还原剂___________。
(8分)Ⅰ.(1)饱和氯化铵溶液显酸性,原因是
________________________________________________________________________
________________________________________________________________________;
向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解;其合理的解释(用相关离子方程式表示)为
________________________________________________________________________
________________________________________________________________________。
(2)向Mg(OH)2悬浊液中加入适量CH3COONH4溶液,
Mg(OH)2能否完全溶解________(填“能”或“否”),理由是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:H2SO4===H++HSO4-,HSO4-===H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”“中性”或“弱碱性”),其理由是________________________________________________________________________
(用离子方程式表示);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度关系正确的是________(填写编号);
A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4)
B.c(OH-)=c(HSO4-)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-)
D.c(Na+)=2c(SO42-)+2c(HSO4-)
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式________________;
(5)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO2-4)=0.029 mol·L-1,则0.10 mol·L-1的H2SO4溶液中c(SO42-)________0.029 mol·L-1(填“<”“>”或“=”),其理由是________________________________________________________________________;
(6)如果25℃时,0.10 mol·L-1H2SO4溶液的pH=
-lg 0.11,则0.10 mol·L-1的H2SO4溶液中c(SO42-)=________mol·L-1。
(8分) (1)1971年美国的斯图杰尔和阿佩里曼在0℃ 以下将氟气从细冰末上通过,成功地合成了一直认为不存在的氟的含氧酸——次氟酸。
①写出次氟酸的结构并标出各元素的化合价__________________;
②次氟酸刹那间被热水分解得到既可表现氧化性 (对NaI)又可表现还原性(对KMnO4)的溶液,写出次氟酸分解反应的化学方程式:____________________________。
(2) 氰(CN)2的化学性质与卤素(X2)很相似称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
①HCN分子中含有4个共价键,写出HCN的结构式:_______ ;
②下列有关方程式不正确的是____________。
A. (CN)2+2NaOH===NaCN+NaCNO+H2O
B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O C.I2+2KCN===2KI+(CN)2
D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2
(8分)(1)2 mol O3和3 mol O2的质量之比________,体积之比________.
(2)若12.4 g Na2X中含有0.4 mol钠离子,Na2X的摩尔质量是________ X的相对原子质量是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com