
题目列表(包括答案和解析)
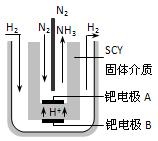
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。下列有关说法中正确的是 
| A.电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B.钯电极B连接的是电源的负极 |
| C.钯电极A的电极反应式为:N2+6e—+6H+==2NH3 |
| D.当有0.3mol电子转移时,有2.688L NH3生成 |
随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。下列有关说法中正确的是 ( )
| A.电解法合成氨的电解池中能用水作电解质溶液的溶剂 |
| B.钯电极B连接的是电源的负极 |
| C.钯电极A的电极反应式为:N2+6e—+6H+==2NH3 |
| D.当有0.3mol电子转移时,有2.688L NH3生成 |
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) △H=―483.6kJ/mol
则反应2H2(g)+2NO(g)=2H2O(g)+N2(g) △H= 。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。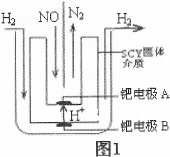
钯电极A为 极,电极反应式为 。
(3)氨法催化还原NO原理如下:
主反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
4NH3(g)+ 4O2(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
4NO(g)+4NH3(g)+3O2(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
有关实验结论如图2、图3所示,据此回答以下问题: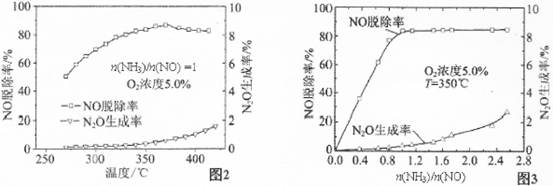
①催化还原NO应控制n(NH3)/n(NO)的最佳值为 ,理由是 。
②主反应平衡常数表达式:K= ,随着温度的增加,K将 (选填“增加”、 “减小”或“不变”。
③影响N2O生成率的因素有 、氧气浓度和 。

 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
1―5ADCCA 6―10DABBC 11―15BCABB 16―20BCDBD
第II卷(共50分)
21.NH3 NO HCl O2 H2
22.(1)略 三角锥
(2)略 H2O2+SO2=H2SO4 4OH-―4e=2H2O+O2
(3)根据液面上升的速率不同区分,氨气的溶解度大于二氧化硫,液面上升的速率
(4)C(OH-) C(SO42-) C(NH4+) C(OH-)
23.(1) bd
(2)①25% 23.1 ②>
(3)阴 N2+6e-+6H-=2NH3
24.(1)Al2O3 H2

|