
题目列表(包括答案和解析)
(08六都中学模拟)(13分)某学校化学兴趣小组同学在两支小试管中分别加入浓度为4mol/L稀盐酸3mL,将分别装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒人试管中,观察到的现象及分析如下:
(1)比较两支试管中的现象: 。
(2)若两气球内的压强相同.两试管大小相同,则大小气球体积之比约为 (填最简整数比)
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq)=H2O(1)+CO2(g);△H>O;
CO32-(aq)+2H+(aq)=H2O(1)+CO2(g);△H<O;
甲分析结论的方法是否科学? 。(填“是”或“否”)
(4)为研究反应是吸热还是放热,乙同学继续进行下列实验。(每个实验平行做三次,取平均值)
序 号 | 试剂l | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5g NaHCO3 的饱和溶液32.5ml | 20℃ | 19℃ |
4 | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶23.1mL+10mL水 | 20℃ | 24.2℃ |
5 | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
6 | 35mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《 》
②通过上述实验可得出五条结论:
a.NaHCO3的溶解是 (“吸热”或“放热”)过程;
b.Na2CO3的溶解是 (“吸热”或“放热”)过程;
c.NaHCO3的饱和溶液和盐酸的反应是 (”吸热”或“放热”)反应;
d.Na2CO3的饱和溶液和盐酸的反应是 (“吸热”或“放热”)反应;
e.NaHCO3固体与稀盐酸反应的反应热是 (填a→d的字母)的热效应之和。
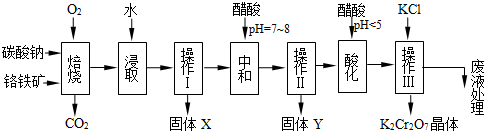
| 750℃ |
| 750℃ |
| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
| 26m |
| 17n |
| 26m |
| 17n |

| ||
| 2MPa |
| ||
| 2MPa |
| △ |
| △ |
1―18 BCDAA BDADB DBBCC BDB
19.(1)略(3分)
(2)根据转移电子分析:4 x 2.5 x 2=n(BrF3) x 3 n(BrF3)=16/15 mol(3分)
20.略
21.略
22.(1)abc
(2)c
|