
题目列表(包括答案和解析)
过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是 。
|

(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是: 。
A. BaO 2 + H2SO 4 === BaSO4 ↓ + H2O2
B. 2NH4HSO4![]() (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
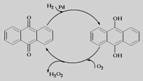
D.乙基蒽醌法:
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
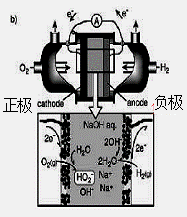
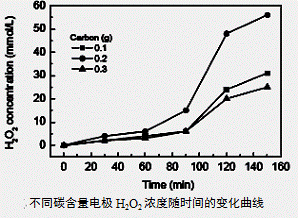
下列说法正确的有 。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜: 。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚: 。
“C1化学”是指以分子中只含一个碳原子的物质为原料进行物质合成的化学。“C1化学”对于缓解日益 严重的能源危机、合理利用煤和天然气等化石燃料、保护环境等都有非常重要的意义。合成气(CO+H2)是 “C1化学”中的常用原料。
(1)煤气化可生成合成气,该反应的化学方程式为____________________,用该方法生产合成气的一个典型缺陷是___________。
(2)将甲烷氧化可制合成气:CH4(g)+1/2O2(g) CO(g)+2H2(g) △H=-35.6 kJ/mol。该反应是_____(填“自发”或“非自发”)反应。
CO(g)+2H2(g) △H=-35.6 kJ/mol。该反应是_____(填“自发”或“非自发”)反应。
(3)通过乙醇制取合成气具有良好的应用前景。由乙醇制取合成气有如下两条路线:
a.水蒸气催化重整:CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g) △H=+255.58 kJ/mol
b.部分催化氧化:CH3CH2OH(g)+1/2O2(g)→ 3H2(g)+2CO(g) △H=+13.76 kJ/mol
下列说法错误的是____。
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大
D.在以上两个反应中,原子利用率较高的是b反应
(4)工业用合成气制备二甲醚的生产流程如下:

 CH3OH(g) △H=-90.7 kJ/mol ①
CH3OH(g) △H=-90.7 kJ/mol ① CH3OCH3(g)+H2O(g) △H = -23.5 kJ/mol ②
CH3OCH3(g)+H2O(g) △H = -23.5 kJ/mol ② CO2(g)+H2(g) △H=-41.2 kJ/mol ③
CO2(g)+H2(g) △H=-41.2 kJ/mol ③  CH3OCH3(g)+CO2(g)的△H=_____。830℃ 时反应③的K=1.0,则在催化反应室中反应③的K_______(填“>”、“<”或“=”)1.0。
CH3OCH3(g)+CO2(g)的△H=_____。830℃ 时反应③的K=1.0,则在催化反应室中反应③的K_______(填“>”、“<”或“=”)1.0。
| ||
| ||
| ||
| ||
近年来,乳酸![]() 成为人们的研究热点之一.乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备.乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水.请回答下列有关问题:
成为人们的研究热点之一.乳酸可以用化学方法合成,也可以由淀粉通过生物发酵法制备.乳酸有许多用途,其中利用乳酸的聚合而合成的高分子材料,具有很好的生物兼容性,它无论在哺乳动物体内或自然环境中,最终都能够降解成为二氧化碳和水.请回答下列有关问题:
(1)乳酸在发生下列变化时所用的试剂是①________,②________;
![]()
(2)由乳酸可以制取 请写出设计合成实验时所涉及的有机反应类型
请写出设计合成实验时所涉及的有机反应类型
________________________________________________________________________
________________________________________________________________________.
(3)聚乙烯、聚苯乙烯材料因难分解而给人类生存环境带来严重的“白色污染”,德国Danone公司开发了聚乳酸材料 它是由乳酸通过________反应制取的.聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式
它是由乳酸通过________反应制取的.聚乳酸包装材料能够在60天自行降解,降解过程分为两个阶段,首先在乳酸菌的作用下水解生成单体,然后乳酸单体在细菌的作用下与氧气反应转化为二氧化碳和水,请写出上述两个反应的化学方程式
________________________________________________________________________
________________________________________________________________________.
(4)若碳原子以单键与四个不同的原子或原子团相结合,则称该碳原子为“手性碳原子”,含有手性碳原子的分子称为“手性分子”,手性分子往往具有一定生物活性.乳酸分子是手性分子,乳酸![]() 的手性碳原子是________号碳原子.
的手性碳原子是________号碳原子.
(5)乳酸的某种同分异构体具有下列性质:能发生银镜反应;1mol该物质跟足量金属钠发生缓慢反应,生成2g氢气;该分子为手性分子.写出该物质的结构简式____________
____________.
题号
1
2
3
4
5
6
7
8
答案
A
A
D
B
B
C
B
D
题号
9
10
11
12
13
14
答案
C
BD
B
AC
CD
BC
三、(本题包括1小题,共10分)
15.(10分)
(1)量筒(1分) 22.80(写22.8不得分)(1分)
(2)①0.6(1分) ②酚酞(1分) 无色溶液变成浅红色,且半分钟内不褪色(2分)
③c(NaOH)= (2分)
(2分)
④B(2分)
四、(本题包括1小题,共12分)
16.(每空均2分,共12分)
(1)B (2)D (3)B、A (4)ABCD
(5)①Cu+H2SO4+H2O2=CuSO4+2H2O;
②H2O2 +

 +H2O;
+H2O;
五、(本题包括2小题,共18分)
17、(10分)
(1)2Fe2++Cl2=2Fe3+(2分) H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol(2分)
 |
 (2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
(2)
(2分) 4NH3+5 O2====4NO
+6H2O(2分)
|