
题目列表(包括答案和解析)
(5分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)下图实验中,当试管1中气体的体积为6mL时,试管2中气体体积约为 mL;电解时往往要加入少量稀硫酸或氢氧化钠,其作用是 。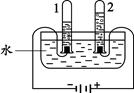
(2)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为 g。
(3)甲、乙两物质的溶解度曲线如图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水
的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃ t℃(填“>”、“<”或“=”)。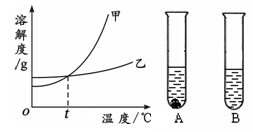
20℃时,对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是 (填字母序号)。
a.加少量水 b.加入少量甲物质
c.升温到40℃ d.蒸发部分溶剂,恢复到20℃
e.加入少量40℃甲的饱和溶液,恢复到20℃


| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |

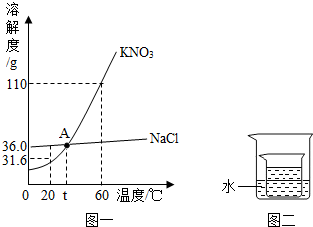
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.8 |
| 加入25gKNO3 |
| 充分搅拌 |
| 加入25gKNO3 |
| 升温到60℃ |
| 降温到20℃ |
| 加入25gNaCl |
| 充分搅拌 |
| 加入25gNaCl |
| 充分搅拌 |
| 加入25g水 |
| 充分搅拌 |
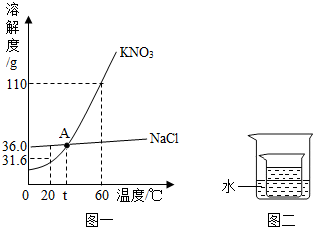
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.8 |
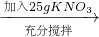 a
a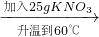
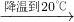 c
c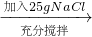 d
d e
e f
f一、选择
1
2
3
4
5
6
7
8
9
10
11
12
B
B
C
B
C
C
C
D
D
A
D
B
二、填空
13.⑴小于 ⑵加入适量甲物质(降温或蒸发溶剂至少量晶体析出)⑶饱和 等于
14.(1)
15.B>C>A(或B、C、A或BCA); 65;B>C>A(或B、C、A或BCA)
16.温度升高,气体的溶解度降低,使水中溶解的氧气量减少;适当降低水的温度,不断通入空气,增大氧气在水中溶解的程度
17.(1)10;(2)甲的溶解度>乙的溶解度;(3)加溶剂(或加水或升温); (4)降温结晶(或冷却热饱和溶液)(每空1分)
(4)降温结晶(或冷却热饱和溶液)(每空1分)
三、简答
19.饱和石灰水升温时,会有固体析出,向饱和石灰水中通入一定量的CO2,会有白色沉淀出现。 原因:饱和石灰水升温,由于Ca(OH)2的溶解度随温度的升高而减小,所以会有固体析出,向饱和石灰水中通入CO2会有沉淀出现,Ca(OH)2+CO2=CaCO3↓+H2O
20.因为饱和氯化钠溶液不能再溶解氯化钠固体,但可以溶解氯化钙、氯化镁等其他杂质, 故可以精制食盐
故可以精制食盐
四、实验与探究
21.(1)右 加速固体溶解 (2) ⑤ ①(3)
22. (1)C (2)C (3)t3 (4)A=B>C
23. B
五、计算
24. 80% ,10%
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com