
题目列表(包括答案和解析)

露置于空气中的NaOH溶液
甲:取少量待测液到试管中,滴入酚酞试液,根据实验现象,甲认为原溶液没有变质;
乙:将足量的盐酸直接加入到试剂瓶中,根据实验现象,乙认为原溶液已经变质;
丙:取少量待测液于试管中,滴入CaCl2溶液,根据实验现象,丙认为原溶液已经变质。
据此,请你进行分析后回答:
(1)根据三位同学的实验结论,三位同学分别观察到什么现象?
甲________________ 乙________________ 丙________________
(2)写出乙同学加入足量盐酸时发生的化学反应方程式:
①一定有的:__________________________②可能有的:__________________________
(3)乙同学的实验操作中不妥之处是________________,如何改进________________。
(4)三位同学中__________的结论是错误的,理由是______________________________。
(5)如果确定原NaOH溶液已变质,三位同学准备继续研究,请你替三位同学提出另一个相关实验问题。
(1)甲同学的方案是:将样品溶解,加入过量氯化钡溶液,过滤,将沉淀洗涤、烘干,称量所得固体质量为n g。
①检验沉淀已经洗净的方法为____________________________________________。
②此混合物中碳酸钠质量分数的计算式为_________________________________________。
(2)乙同学的方案是:将样品溶解,加入过量氯化钡溶液,再滴入2—3滴酚酞试液,用a mol/L标准盐酸滴定,到达滴定终点时消耗盐酸b mL。
①乙同学在滴定过程中所需要的主要玻璃仪器有______________、______________。
②此混合物中碳酸钠质量分数的计算式为______________。
(3)丙同学的方案如下图所示:
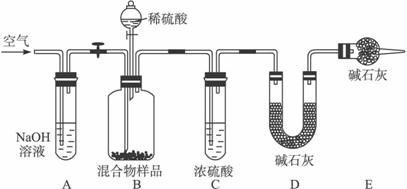
①装置C的作用是____________________________________________________。
②当混合物样品充分反应后,缓慢通入空气的目的是:_____________________________。
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+
ΔH>0。
CH3COO-+H+
ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:

①NaOH溶液滴定CH3COOH溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.80×10-13,在此温度下,将pH=3的盐酸和
pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)mol/L。
醋酸和盐酸是中学化学中常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
(1)常温下,在 pH =5的稀醋酸溶液中,c(CH3COO-)=____________(列式,不必化简);下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是______?
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:v(盐酸)_________v(醋酸)。(填写“>”、“<”或“=”)
(3)某同学用0.1000mol/LNaOH溶液分别滴定20.00mL 0.1000mol/LHCl和20.00mL0.1000mol/L CH3COOH,得到如图所示两条滴定曲线,请完成有关问题:
①NaOH溶液滴定CH3COOH溶液的曲线是 (填“图1”或“图2”);
②a= mL。
(4)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(5)已知:90℃时,水的离子积常数为Kw = 3.80×10-13,在此温度下,将pH=3的盐酸和
pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)mol/L。
 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com