已知乙二酸(HOOC-COOH,可简写为H
2C
2O
4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.某校研究性学习小组为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO
3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为
HCO3-+H2C2O4=HC2O4-+CO2↑+H2O
HCO3-+H2C2O4=HC2O4-+CO2↑+H2O
.
(2)向盛有少量乙二酸饱和溶液的试管中滴入用硫酸酸化的KMnO
4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有
还原性
还原性
(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
2
2
MnO
4-+
5
5
H
2C
2O
4+
6
6
H
+=
2
2
Mn
2++
10
10
CO
2↑+
8
8
H
2O
(3)将一定量的乙二酸放于试管中,按如图所示装置进行实验(夹持装置未标出):
实验发现,装置C、G中澄清石灰水变浑浊,B中CuSO
4粉末变蓝,F中CuO粉末变红,

据此,乙二酸分解的产物为
CO、CO2、H2O
CO、CO2、H2O
.上述装置中,D的作用是
除去混合气体中的CO2
除去混合气体中的CO2
. 装置F中发生反应的化学方程式为:
.
(4)该小组同学将2.52g草酸晶体(H
2C
2O
4?2H
2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是
反应所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性
反应所得溶液为NaHC2O4溶液,由于HC2O4-的电离程度比水解程度大,导致溶液中c(H+)>c(OH-),所以溶液呈酸性
.


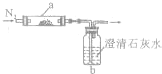 (2011?宝鸡三模)取化学式为XY的黑色粉末状化合物进行如下实验.将XY和足量新制干燥的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按下图连接仪器进行实验.
(2011?宝鸡三模)取化学式为XY的黑色粉末状化合物进行如下实验.将XY和足量新制干燥的碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按下图连接仪器进行实验.
