(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ-mol-1) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
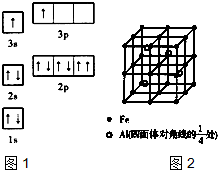
①某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______、______,B元素位于周期表五个区域中的______区.
②ACl
2分子中A的杂化类型为______,ACl
2空间构型为______.
(2)Fe原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是______.
②六氰合亚铁离子[Fe(CN)
6]
4-中不存在______.
A.共价键 B.非极性键 C.配位键 D.σ键 E.π键
写出一种与CN
-互为等电子体的单质的分子式______.
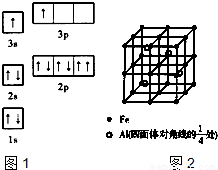
(3)一种Al-Fe合金的立体晶胞如图2所示,请据此回答下列问题:
①确定该合金的化学式______.
②若晶体的密度为ρg-cm
-3,该晶胞棱长为______cm(用含ρ和N
A的代数式表示,不必化简.

 (1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
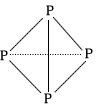 ,请画出C4A44+(每个原子最外层均达到 稳定结构)的结构式:___(A、C用元素符号表示)。
,请画出C4A44+(每个原子最外层均达到 稳定结构)的结构式:___(A、C用元素符号表示)。