
题目列表(包括答案和解析)
(6分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应为_____________ _,若反应过程中转移了2mol电子,可产生水的质量为 g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,.其中c(Na+)= 3 c(Cu2+ )= 0.3 mol/L,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(已折算到标准状况)气体。此时氢氧燃料电池外电路中转移电子的物质的量为 mol。(不考虑电路中的其它损耗)。
【解析】(1)在燃料电池中正极通入的是氧气,所以正极反应式为O2 + 4H+ + 4e-= 2H2O。因为总反应是O2 + 2H2 = 2H2O,反应中转移的电子是4mol,所以若反应过程中转移了2mol电子,可产生水的质量为18g。
(2)在阴极上首先是铜离子放电,析出铜,然后是氢离子放电,生成氢气。铜离子是0.1mol/L×0.1L=0.01mol,得到的电子是0.02mol。氢气是![]() ,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
(6分)氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为硫酸,其正极反应为_____________ _,若反应过程中转移了2mol电子,可产生水的质量为 g。
(2)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,.其中c(Na+)= 3 c(Cu2+ )= 0.3 mol/L,取该混合液100 mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112 L(已折算到标准状况)气体。此时氢氧燃料电池外电路中转移电子的物质的量为 mol。(不考虑电路中的其它损耗)。
【解析】(1)在燃料电池中正极通入的是氧气,所以正极反应式为O2 + 4H+ + 4e- = 2H2O。因为总反应是O2 + 2H2 = 2H2O,反应中转移的电子是4mol,所以若反应过程中转移了2mol电子,可产生水的质量为18g。
(2)在阴极上首先是铜离子放电,析出铜,然后是氢离子放电,生成氢气。铜离子是0.1mol/L×0.1L=0.01mol,得到的电子是0.02mol。氢气是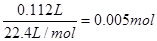 ,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
,转移的电子是0.01mol,所以转移的总的电子是0.03mol。
| A、1:1 | B、4:3 | C、2:1 | D、3:2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com