
题目列表(包括答案和解析)
(16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
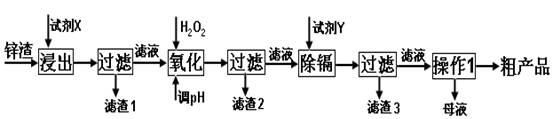
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强;SiO2是不溶于水和酸(HF除外)的酸性氧化物。
试回答下列问题:
(1)“浸出”时用到的“试剂X” 选 。
A.H2SO4(aq) B.HCl(aq) C.HNO3(aq)
“滤渣1”的主要成分是 _(填化学式)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。
A.H2SO4 B.ZnO C.NaOH
(4)“试剂Y” 选______________。
A.Cd B.Zn C.Fe
(5)“操作1”的方法是_____、______、_______。
(1)、熔点沸点HF HI;原因:
(2)、各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为
(3)、下列4种物质熔点沸点由高到低排列为________ (填序号)
①金刚石(C—C)②锗(Ge—Ge)
③晶体硅(Si—Si)④金刚砂(Si—C)
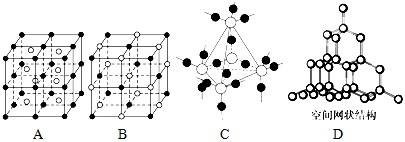
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。
晶体中每个Na+同时吸引着______个Cl-,由这些 Cl-构成的几何构型为 晶体中在每个Cl-周围与它最接近且距离相等的Cl-共有________个。
(5)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
(6)某元素原子的价电子构型为3d104S2,它属于第 周期,是 族, 区元素,元素符号是 。该原子核外有 个能级,电子云的形状有 种
(16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下: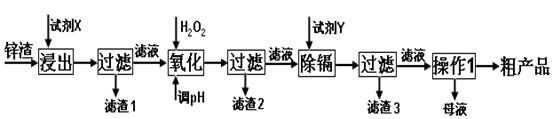
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强;SiO2是不溶于水和酸(HF除外)的酸性氧化物。
试回答下列问题:
(1)“浸出”时用到的“试剂X” 选 。
A.H2SO4(aq) B.HCl(aq) C.HNO3(aq)
“滤渣1”的主要成分是 _(填化学式)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。
A.H2SO4 B.ZnO C.NaOH
(4)“试剂Y” 选______________。
A.Cd B.Zn C.Fe
(5)“操作1”的方法是_____、______、_______。
(1)、熔点沸点HF HI;原因:
(2)、各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为
(3)、下列4种物质熔点沸点由高到低排列为________ (填序号)
①金刚石(C—C)②锗(Ge—Ge)
③晶体硅(Si—Si)④金刚砂(Si—C)
(4)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。

晶体中每个Na+同时吸引着______个Cl-,由这些 Cl-构成的几何构型为 晶体中在每个Cl-周围与它最接近且距离相 等的Cl-共有________个。
(5)某元素的激发态原子的电子排布式为1s 2s
2s 2p
2p 3s
3s 3p
3p 4s
4s ,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
(6)某元素原子的价电子构型为3d104S2,它属于第 周期,是 族, 区元素,元素符号是 。该原子核外有 个能级,电子云的形状有 种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com