
题目列表(包括答案和解析)
实验室通过加热氯化铵与氢氧化钙的混合物制备氨
(如图所示):2NH4Cl+Ca(OH)2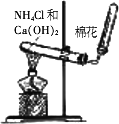
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
①X的化学式为__________,属于________(填“极性”或“非极性”)分子。 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
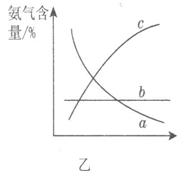
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后, 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是 。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
①X的化学式为__________,属于________(填“极性”或“非极性”)分子。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是 。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl) c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com