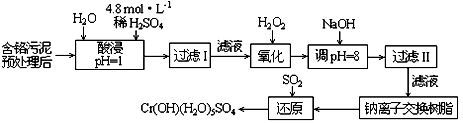
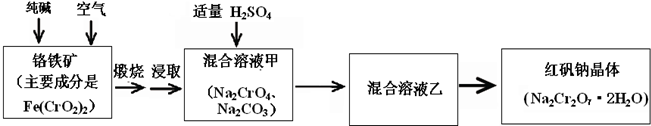
(2012?朝阳区二模)重铬酸钠俗称红矾钠(Na
2Cr
2O
7?2H
2O)是重要的化工产品和强氧化剂.工业制备的流程如下:
请回答:
(1)已知Fe(CrO
2)
2中铬元素是+3价,则Fe(CrO
2)
2中铁元素是
+2
+2
价.
(2)化学上可将某些盐写成氧化物的形式,如Na
2SiO
3可写成Na
2O?SiO
2,则Fe(CrO
2)
2可写成
FeO?Cr2O3
FeO?Cr2O3
.
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO
2)
2生成可溶于水的Na
2CrO
4,反应化学方程式如下:
4Fe(CrO
2)
2+8Na
2CO
3+7O
2=2Fe
2O
3+8Na
2CO
4+8CO
2为了加快该反应的反应速率,可采取的措施是
粉碎矿石、升高温度
粉碎矿石、升高温度
.
(4)已知CrO
42-在不同的酸性溶液中有不同的反应,如:
2CrO
42-+2H
+=Cr
2O
72-+H
2O;
3CrO
42-+4H
+=Cr
3O
102-+2H
2O
①往混合溶液甲中加入硫酸必须适量的原因是
少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物
少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物
.
②混合溶液乙中溶质的化学式是
Na2Cr2O7和Na2SO4
Na2Cr2O7和Na2SO4
.
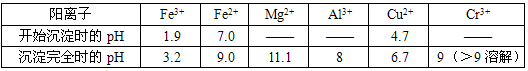
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr
2O
72-必须除去.

工业上可用电解法来处理含Cr
2O
72-的废水,如图为电解装置示意图(电极材料分别为铁和石墨).通电后,Cr
2O
72-在b极附近转变为Cr
3+,一段时间后Cr
3+最终可在a极附近变成Cr(OH)
3沉淀而被除去.
a电极的电极反应式是
2H++2e-=H2↑
2H++2e-=H2↑
,b电极附近反应的离子方程式是
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
.