
题目列表(包括答案和解析)
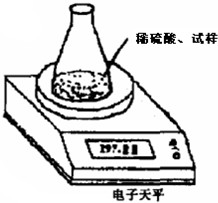 如图装置测定因存放不当而部分变成碳酸钠的烧碱中氢氧化钠的质量分数.所取试样质量8.00g、锥形瓶质量140.00g,加入足量稀硫酸(质量为50.00g)每隔相同时间读数一次,数据如下表:
如图装置测定因存放不当而部分变成碳酸钠的烧碱中氢氧化钠的质量分数.所取试样质量8.00g、锥形瓶质量140.00g,加入足量稀硫酸(质量为50.00g)每隔相同时间读数一次,数据如下表:| 读数次数 | 质量/g | |
| 锥形瓶+试样+稀硫酸 | 第1次 | 197.64 |
| 第2次 | 197.48 | |
| 第3次 | 197.26 | |
| 第4次 | 197.16 | |
| 第5次 | 197.12 | |
| 第6次 | 197.12 |
| 次数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
| 剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
| 加入稀硫酸的次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 烧杯内剩余固体质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.
【查阅资料】(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气.
(2)相对原子质量:Mg﹣24、Fe﹣56、Zn﹣65
【实验步骤及数据】取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
|
次数 |
1 |
2 |
3 |
4 |
|
加入稀硫酸的质量/g |
35.O |
35.0 |
35.O |
35.O |
|
剩余固体的质量/g |
6.8 |
5.6 |
4.4 |
4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
(2008年攀枝花市)现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成。
【查阅资料】(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气。
(2)相对原子质量:Mg-24、Fe-56、Zn-65
【实验步骤及数据】取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
|
次数 |
1 |
2 |
3 |
4 |
|
加入稀硫酸的质量/g |
35.O |
35.0 |
35.O |
35.O |
|
剩余固体的质量/g |
6.8 |
5.6 |
4.4 |
4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com